На исходе ХХ-го века биотехнология, фармакология и генная инженерия, развивались чрезвычайно динамично. В ХХI-м же веке им предстоит играть роль ведущих отраслей науки. Их применение будет способствовать прогрессу в медицине и здравоохранении, сельском хозяйстве и производстве продуктов питания.
Несмотря на огромный прогресс в медицине и успех в фармакологии, достигнутые в прошлом, перед учеными все еще непочатый край работы. Сегодня врачи научились устранить причину лишь одной третьей из примерно 30 тысяч известных заболеваний. Что касается остальных двух третьих, то доктор вынужден либо лечить симптомы, либо вообще ничего не предпринимать. Кроме того, возникают дополнительные проблемы: известны, считавшиеся побежденными возбудители болезней приобретает резистентность. По всему миру быстро распространяется новые заболевания, чему способствует растущая мобильность людей. В промышленно развитых странах с ростом числа пожилых людей увеличивается доля хронических и возрастных заболеваний.
Генная инженерия и, прежде всего расшифровка геном человека позволяют создавать новые лекарственные препараты. Если мы будем лучше понимать роль генов в развитии болезней и то, как протекают процессы в наших клетках на молекулярном уровне, сможем более целенаправленно вести исследования. С помощью генетики и биотехнологии мы сможем в будущем более эффективно выявлять причины заболеваний; тем самым исследования в области фармакология – это существенный шаг вперед в деле создания новых лекарств, устраняющих саму почину болезни. Большой интерес в этом предоставляют протеолитические ферменты растительного происхождения [1].
На заседании Кабинета Министров Туркменистана, состоявшемся 14 августа 2015 г., Президент страны Гурбангулы Бердымухамедов подчеркнул необходимость увеличения числа тепличных хозяйств по производству сельхозпродукции с целью круглогодичного обеспечения ею населения страны. Опыт работы тепличных хозяйств Лебапского велаята свидетельствует о том, что помимо овощей и фруктов, в них можно выращивать и другие растения, например, дынное дерево [1–5].
Химические и физические свойства протеолитических ферментов дынного дерева
1. Биологические активные вещества дынного дерева
Биологические активные вещества. Методом электрофореза в кислой среде в латексе дынного дерева (Carica papaya L.) идентифицировано 7 белков: липаза, хитиназа, лизоцим и комплекс протеолитических ферментов:
Папаин (EC 3.4.22.2) – монотиоловая цистеиновая эндопротеаза. По характеру ферментативного действия ее называют «растительным пепсином». Но, в отличие от пепсина, папаин активен не только в кислых, но и в нейтральных и щелочных средах (диапазон рН 3–12, оптимум рН 5). Он сохраняет активность в широком температурном диапазоне. В каталитическом центре папаина содержится дитиоацильная группа. Фермент связывается с субстратом в местах локализации дисульфидных связей, отдавая преимущество ароматическому аминокислотному остатку в следующей позиции (Jacquet A. etc., 1989). Ген папаина клонирован и секвернирован (Cohen L.W. etc., 1986). Установлено, что он продуцируется растением в виде пропапаина, который после отщепления пептидного фрагмента превращается в активный фермент – папаин. Ген пропапаина, полученный из плодов папайи, клонирован в дрожжах Saccharomyces cerevisiae (Ramjee M.K. etc., 1996) [2–19].
Химопапаин (EC 3.4.22.6) – монотиоловая цистеиновая протеиназа. Благодаря субстратной специфичности похожа на папаин, но отличается от него электрофоретической подвижностью, стойкостью и растворимостью. Это полипепдид, состоящий из 218 аминокислотных остатков, проявляет значительное структурное сходство с папаином и протеиназой w папайи, включая консервативный каталитический участок и дисульфидные связи (Watson D.C. etc., 1990). Из латекса в процессе хроматографии выделяется несколько изоферментных фракций химопапаина: химопапаин А, В и М. Тем не менее иммунологические исследования указывают на их гомогенность (Buttle D.J. и Barrett A.J., 1984). Установлено, что химопапаин М идентичен ранее описанным цистеиновым протеиназам папайи пептидазе В и протеиназе IV (Thomas M.P. etc., 1994). По специфичности ферментативного действия напоминает папаин, поскольку связывается с субстратом в сайтах локализации дисульфидных связей, но, в отличие от папаина, расщепление субстрата происходит только в том случае, если в следующей позиции находятся лейцин, валин, треонин или пролин. Активность химопапаина измеряют в нанокаталитических (нКат) и пикокаталитических (пКат) единицах; 1 мг фермента содержит по крайней мере 0,52 нКат единиц [2–19].
Протеиназа IV – цистеиновая протеиназа, основная протеиназа латекса, составляет около 30 % присутствующего в нем белка (Buttle D.J. etc., 1989). Проявляет высокую степень гомологии с протеиназой III папайи (81 %), химопапаином (70 %) и папаином (67 %). Очень близка к химопапаину по молекулярной массе и заряду молекулы. Загрязнение этим ферментом химопапаина является причиной его гетерогенности в ходе исследований. M.P. Thomas и соавт. (1994) относят этот фермент к фракции химопапаина М.
Карикаин (EC 3.4.22.30) – наиболее щелочная среди цистеиновых протеиназ латекса папайи. Подобно папаину, он сначала продуцируется в форме неактивного зимогена прокарикаина, содержащего ингибиторный прорегион из 106 N-терминальных аминокислот. Активация фермента заключается в отщеплении прорегиона молекулы без ее последующих конформационных изменений. Строение протеиназ папайи изучено с помощью рентгенструктурного анализа (Maes D. etc., 1996) [2–19].
Протеиназа w (эндопептидаза А, пептидаза А) – монотиоловая цистеиновая протеиназа. Это полипептид, содержащий 216 аминокислотных остатков и 3 дисульфидные связи. Для проявления его ферментативной активности важно наличие свободного остатка цистеина в активном центре (Dubois T. etc., 1988). Проявляет высокую степень гомологии с папаином (68,5 %). По специфичности ферментативного действия напоминает папаин, поскольку связывается с субстратом в участках локализации дисульфидных связей. Расщепление происходит тогда, когда в следующей позиции находятся лейцин, валин или треонин. Пептидаза ІІ – щелочная монотиоловая цистеиновая протеиназа. В каталитическом центре содержит дитиоацильную группу. Глицил-эндопептидаза (EC 3.4.22.25) [2–19].
В латексе неспелых плодов папайи содержатся также ингибиторы протеолитических ферментов: цистатин (ингибитор протеиназ с молекулярной массой 11 262 Да) и белок со свойствами ингибитора цистеиновых протеиназ, молекула которого состоит из 184 аминокислотных остатков, содержит 2 дисульфидные связи и 2 углеводных остатка в позициях Asp84 и Asp90 (Odani S. etc., 1996). Последний обладает способностью блокировать активность трипсина крупного рогатого скота и α-химотрипсина за счет экранирования участков связывания этих ферментов на их субстратах. Важное медицинское значение имеет комплекс ферментов латекса папайи – папаин. В состав этого комплекса входит несколько протеолитических ферментов, среди которых пептидаза I (расщепляющая белки на ди- и полипептиды), ренинподобный коагулирующий фермент (свертывает казеин молока), амилолитический фермент, свертывающий фермент, подобный пектазе, и слабый липолитический фермент [2–19].
Свойство папаина. Папаин расщепляет белки до полипептидов и аминокислот, причем гидролизирует любые пептидные связи, за исключением связей пролина и связей глютаминовой кислоты с дисоциированной карбоксильной группой. Папаин обладает большей способностью к расщеплению белков по сравнению с большинством протеаз животного и бактериального происхождения. Хотя активность препаратов папаина отличается в зависимости от способа приготовления, он обладает способностью расщеплять нежирное мясо в количестве, в 35 раз превышающем его собственную массу. Папаин высокого качества переваривает яичный альбумин, количество которого в 300 раз больше его собственной массы. При кипячении папаин инактивируется. Глютатион, цистеин и тиосульфат повышают активность папаина, а медь и перекись водорода – угнетают ее. Резко повышает активность папаина синильная кислота в микродозах, которые могут быть введены перорально (семена яблок, вишен, миндаля или абрикос). Е. Smith и соавт. в 1955 г. обнаружил и получил в кристаллическом виде из млечного сока дынного дерева лизоцим, который отличается от лизоцимов другого происхождения (белка куриного яйца, селезенки кролика и собаки) большей молекулярной массой (приблизительно 25000 кДа) и аминокислотным составом. В плодах папайи найдено 56 летучих органических кислот, среди которых преобладает бутаноевая кислота (1,2 мг/кг), а также терпеновые соединения, в частности линалоолоксиды. В спелых плодах дынного дерева содержится 8–12 % сахара, значительное количество витаминов А, В1, В2, С и D, тонизирующие вещества. В листьях папайи выявлены свободные и связанные фенольные соединения, танины, органические кислоты и алкалоиды. Другие возможностях папаина приведены на схеме.
В кулинарии, помимо уникальных качеств, у папайи есть еще одно немаловажное достоинство – универсальность. Она может использоваться и как фрукт, и как овощ, и как лекарство. Как так? – удивитесь вы. Очень просто. Спелая папайя – фрукт, ее едят на десерт, слегка полив соком лимона или лайма, недозрелая – овощ, и используется как компонентовощных салатов и гарниров. А высушенные и размолотые зерна папайи – прекрасная специя, которую добавляют в соусы и винегреты [2–19].
Внутри плодов находятся семена, в состав которых входят: олеиновая, пальмитиновая, стеариновая, линолевая, архидоновая кислоты, применяемые для лечения атеросклероза, и других болезней, а также для изготовления моющих средств, пластификаторов, пеногасителей и прочих изделий, широко применяемых в различных отраслях промышленности.
В листьях имеются свободные и связанные фенольные соединения, танины, органические кислоты, стероидные и тритерпеновые сапонины, флавониды, липиды, кумарины, глюкозы, альколоиды, применяемые при лечении туберкулеза и обладающие желче- и мочегонными свойствами. В Перу листья папайи славятся как незаменимое средство для заживления ран [16–21].
Недавно папайя произвела сенсацию в медицинском мире: индийские ученые обнаружили, что в коре дынного дерева (на котором, как мы говорили, и растения папайя) содержится вещество, в 250 раз более эффективно подавляющее рост раковых клеток, чем самые современные и продвинутые лекарства. Сейчас ведутся исследования (кора никогда прежде не использовалась в медицине), если не будут выявлены противопоказания, папайя даст миру действенное средство от страшной болезни.
В пищевой промышленности плоды дынного дерева идут на приготовление тонизирующих напитков, соков, сиропов, желе.
В пивоваренном производстве и виноделии протеолитический фермент папаин используется для осветления растворов и увеличения срока хранения.
В текстильной промышленности добавка папаина уменьшает скручивание нити и предотвращает усадку шерсти.
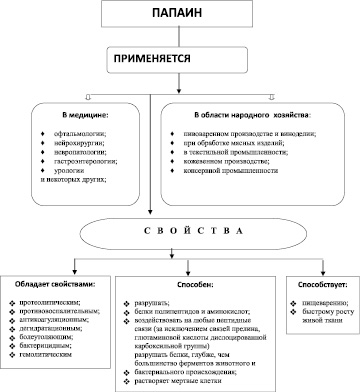
Рис. 1. Схема свойств и применения фермента папаина в народном хозяйстве
В фармацевтической промышленности зарубежных стран выпускается более 100 лекарственных препаратов (лекозим, лекопаин, вобензим, карпазим, кариказа, супер – сжигатель жира N1, бионормалайзер и многие др.), широко применяемых в различных областях медицины [2–5, 16–21].
Например, лекарственный препарат Лекозим – лиофилизированная смесь растительных протеолитических ферментов дынного дерева. Она белого цвета, без запаха и вкуса, хорошо растворимая в воде.
Химически Лекозим – 99 % белок, состоящий из папаина (12,4 %), химопапаина (43,5 %), лизоцина (17,4 %) и протеиназы X (26,7 %). Специфическая активность – 6–7 МЕД ед./мг, что соответствует FIP единицам (FIP – Международная фармацевтическая федерация). Известны различия в аминокислотном составе отдельных протеолитических ферментов, входящих в Лекозим. Папаин не содержит метионина, в химопапание его очень мало, а в лизоцине много. Во всех ферментах высоко содержание глицина, а химопапаине, в отличие от других двух энзимов, больше лицина.
N – терминальная группа папаина – изолейцин, химопапаина – глютаминовая кислота, лизоцина – глицин. Ферменты, входящие в состав Лекозима – основные белки, имеющие изоэлектрическую точку в щелочной области. Приблизительный молекулярный вес папаина – 21 000, химопапаина – 36 000, лизоцима – 25 000. Энзимы эти легко окисляются и связываются с тяжелыми металлами, которые ингибируют их; при температуре более 70° они инактивируются. При длительном сохранении в растворенном состоянии теряют активность. Неочищенная смесь стабильная больше года, очищенный препарат менее стабилен. Папаин, химопапаин и протеиназа X – протеолитически активные энзимы, лизоцим-мукополисахарид.
2. Дизайн субстратов цистеиновых пептидаз семейства С1
В своей научно-исследовательской работе Т.А. Семашко «Новые селективные пептидные субстраты цистеиновых пептидаз семейства папаина» рассмотрела задачу получение пептидных субстратов семейства папаина, которые отвечали бы следующим требованиям:
1) соответствие аминокислотной последовательности субстратов специфичности ферментов;
2) наличие в субстратах таких структурных элементов, которые обеспечивали бы возможность прямого детектирования ферментативной активности. В соответствии с этим структура субстратов может быть выражена общей формулой
A – Хаа – YaavB,
где А = Glp (пироглутамил) Abz (о-аминобензоил); В = pNA (п-нитроанилид), AMC (7-амидо-4-метилкумарин) и AFC (7-амидо-4-трифторметилкумарин); Xaa = Phe, Val; Yaa = Ala; место предполагаемого гидролиза субстратов показано стрелкой. Поскольку субстратсвязывающая область цистеиновых катепсинов невелика по размерам, предлагаемые субстраты – короткие ди- и трипептиды. Исходя из анализа имеющихся литературных данных, мы предположили, что в подцентре Р1 субстратов может находиться небольшой по размеру аминокислотный остаток аланина (Yaa = Ala). В положении P2, которое является определяющим для специфичности пептидаз семейства С1, находятся гидрофобные остатки (Xaa = Phe, Val). N-концевая группировка субстратов (А) представлена остатками пироглутаминовой (Glp) и о-аминобензойной кислот (Abz). Остаток пироглутаминовой кислоты, являясь более гидрофильным, чем большинство использующихся защитных групп, введен для обеспечения растворимости субстратов в водно-органических смесях. Группировка Abz является флуорогенным маркером. В качестве С-концевых остатков (В) использованы хромогенная п-нитроанилидная (pNA) и флуорогенные 7-амино-4-метил- и 7-амино-4-трифторметилкумаридные группировки (AMC) и (AFC) соответственно, присутствие которых обеспечивает простоту и высокую чувствительность анализа ферментативной активности по изменению спектральных и флуоресцентных характеристик субстратов в ходе гидролиза. Таким образом, нами были предложены следующие субстраты: Glp-Phe-Ala-pNA (I), Glp-Val-Ala-pNA (II), Abz-Phe-Ala-pNA (III), Glp-Phe-Ala-АМС (IV) и Glp-Phe-Ala-АFС (V).
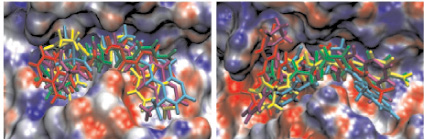
а б
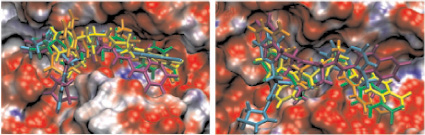
в г
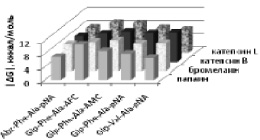
д
Рис. 2. Моделирование положения субстратов (I)–(V) в зоне связывания папаина (а), бромелина (б), катепсина В (в), ктепсина L (г). Glp-Phe-Ala-pNA (I) – отмечен желтым цветом, Glp-Val-Ala-pNA (II) – зеленым, Abz-Phe-Ala-pNA (III) – красным, Glp-Phe-Ala-АМС (IV) – голубым и Glp-Phe-Ala-АFС (V) – фиолетовым. д – модуль энергии связывания полученных комплексов
Возможность всех предложенных соединений являться субстратами цистеиновых пептидаз семейства С1 была проверена с помощью метода молекулярного докинга. На рис. 2, а–г показано возможное связывание предложенных субстратов с молекулами папаина, катепсинов В и L и моделью бромелаина, построенной гомологичным моделированием на основе пространственной структуры химопапаина. На рис. 2, д представлены модули энергии связывания полученных комплексов. Было показано, что все вышеперечисленные соединения могут связываться в районе активного центра выбранных пептидаз в конформации, благоприятствующей дальнейшему расщеплению субстратов только по предполагаемой для гидролиза пептидной связи, и, следовательно, являться субстратами исследованных пептидаз.
3. Химико-энзиматический синтез субстратов цистеиновых пептидаз семейства С1
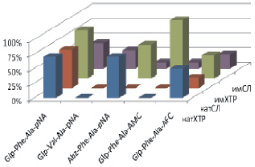
Рис. 3. Ферментивный синтез субстатов (I)–(V) с использованием нативых и иммобилизованных ферментов
На первом этапе был проведен химический синтез карбоксильных и ряда аминокомпонентов пептидной конденсации. Для получения карбоксильных компонентов – Abz-Phe-OMe, Glp-Phe-OMe, Glp-Val-OMe были разработаны методики, основанные на применении метода активированных эфиров. Синтез аминокомпонентов пептидной конденсации – Ala-pNA и Gln-pNA проводили с Boc-производными аминокислот и п-нитроанилином в присутствии POCl3 с последующим удалением защитных групп.
Заключительной стадией синтеза субстратов являлась ферментативная конденсация компонентов: фермент
A-XaaOMe + H-Ala-B > A-Xaa-Yaa-B + MeOH,
где A = Glp, Abz; Xaa = Phe, Val; B = pNA, AMC, AFC.
Ферментативное образование пептидной связи гарантировало селективность протекания реакции, обеспечивало оптическую чистоту целевых соединений, а также позволило упростить схему синтеза и выделения продуктов. В качестве катализаторов использовались пептидазы α-химотрипсин (ХТР) и субтилизин Карлсберг (СЛ), специфичность которых удовлетворяла структуре синтезируемых субстратов. Возможность проведения ферментативного синтеза субстратов была исследована в двух вариантах: (1) под действием нативных ХТР и СЛ в смеси DMF/водный буфер 50/50 об. % и (2) с использованием модифицированных ферментов в безводной среде полярных органических растворителей (DMF-MeCN (20/80 об. %)).
В случае проведения синтезов под действием нативных ферментов концентрация исходных соединений составляла 0,13 М, концентрация ферментов – 50 мкМ ([S]:[E] = 2600:1). Смещение равновесия в сторону синтеза определялось ускорением образования ацилфермента за счет активации карбоксильного компонента, содержащего сложноэфирную группу.
Дополнительным фактором смещения равновесия в сторону синтеза являлось выведение продукта из сферы реакции за счет выпадения его в осадок.
Было показано, что под действием нативных пептидаз в водно-органической среде может быть проведен синтез только некоторых субстратов – Glp-Phe-Ala-pNA (I) под действием ХТР и СЛ с выходами 70 и 66 % соответственно, Abz-Phe-Ala-pNA (III) под действием ХТР с выходом 70 % и Glp-Phe-Ala-AFC (V) под действием ХТР и СЛ с выходами 50 и 18 % соответственно.
Более универсальным оказалось проведение ферментативного синтеза субстратов в безводной органической среде под действием ХТР и СЛ, иммобилизованных на криогеле поливинилового спирта (КПВС). Реакция проводилась в смеси DMF-MeCN (20/80 об. %), молярные соотношения фермент/субстрат составляли для синтеза с использованием СЛ 1/(3600–5600), ХТР – 1/(800–2200). Сдвиг равновесия в сторону синтеза осуществлялся благодаря недостатку воды в реакционной смеси. В отличие от водной среды, в органических растворителях под действием иммобилизованных ферментов удалось получить все субстраты, однако эффективность синтеза была различна. В исследованных нами условиях синтез субстратов (I) и (III)–(V), содержащих остаток Phe, проходил гораздо лучше под действием иммобилизованного ХТР (выходы целевых соединений варьировались от 11 до 100 % (в случае Glp-Phe-Ala-AMC)), в то время как под действием иммобилизованного СЛ выходы не превышали 44 % (Glp-Phe-Ala-pNA (I)). Вместе с тем, синтез Glp-Val-Ala-pNA (II) удалось осуществить только с использованием СЛ – в присутствии ХТР образования этого пептида не наблюдалось.
Возможность повторного использования иммобилизованных биокатализаторов была показана на примере синтезов Glp-Phe-Ala-pNA (I) и Glp-Phe-Ala-AMC (IV) под действием ХТР, иммобилизованного на КПВС. Выход пептида (I) был достаточно высоким (70–80 %) и практически не менялся даже после 6-кратного использования одного и того же образца биокатализатора. В случае Glp-Phe-Ala-AMC эффективность синтеза была одинаковой на протяжении двух циклов. За 4 ч выход (IV) составил 50 % и достиг количественного за 48 ч.
В целом, эффективность синтеза производных с Phe выше при использовании ХТР, а с Val – при использовании СЛ. Перспективным методом является получение целевых соединений в органических растворителях с использованием иммобилизованных на КПВС ХТР и СЛ, поскольку в этом случае решается проблема растворимости гидрофобных компонентов.
Иммобилизация пептидаз в этом случае позволяет повысить устойчивость белков к денатурации и дает возможность повторного использования катализаторов. При проведении пептидного синтеза в водно-органических смесях под действием нативных ХТР и СЛ выход целевых продуктов, как правило, выше, синтез проходит быстрее и с меньшим количеством биокатализатора.
Все синтезированные пептиды представляют собой устойчивые кристаллические соединения. Все соединения охарактеризованы величинами хроматографической подвижности в нескольких системах (ТСХ), временами удерживания (ВЭЖХ), данными аминокислотного анализа, масс-спектрометрии и ЯМР (табл. 1). Получены спектры поглощения п-нитроанилидных производных, а также спектры возбуждения и испускания соединений, содержащих флуоресцентные маркерные группировки. Полученные физико-химические характеристики синтезированных соединений (I)–(V) свидетельствуют об их химической гомогенности и спектральной чистоте.
Таблица 1
Физико-химические характеристики синтезированных субстратов
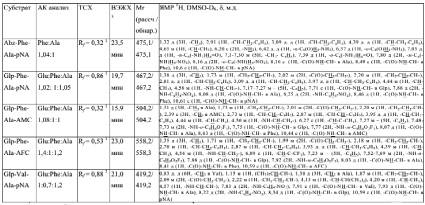
Примечания: 1В системе бензол-ацетон-уксусная кислота(100:25:4);
2В системе н-бутан-вода-пиридин-уксусная кислота (15:12:10:3);
30,1% TFA в линейном градиенте MeCN (1 мл/мин) от 10 до 70 % за 30 мин на колонке С18 (4,6/250 мм).
4. Гидролиз субстратов цистеиновыми пептидазами семейства С1
Гидролиз полученных пептидомиметиков (I)–(V) изучали под действием цистеиновых пептидаз семейства С1 – растительных ферментов папаина, бромелаина, фицина, а также лизосомальных катепсинов млекопитающих и человека В и L. Для анализа субстратной специфичности вышеперечисленных пептидаз мы использовали также Z-Ala-Ala-Gln-pNA (VI).
Все исследуемые субстраты расщеплялись цистеиновыми пептидазами семейства С1. Однозначность расщепления соединений (I)–(VI) по единственной связи между аминокислотным остатком в Р1-положении и соответствующей маркерной группировкой (pNA, AMC, AFC) была показана на примере гидролиза их папаином методом ВЭЖХ.
Субстраты (I)-(VI) сравнивались по двум характеристикам: (1) по эффективности гидролиза цистеиновыми пептидазами семейства С1, которая характеризуется скоростью гидролиза и оценивается коэффициентом специфичности ферментативной реакции kcat/KM и (2) по селективности, т.е. устойчивости субстратов к действию пептидаз других кланов.
4.1. Кинетика гидролиза субстратов цистеиновыми пептидазами семейства С1
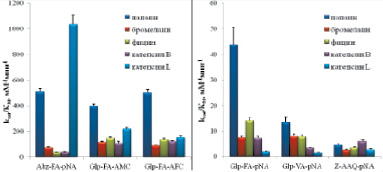
Кинетические константы гидролиза синтезированных субстратов цистеиновыми пептидазами представлены на рис. 4. Видно, что флуорогенные субстраты по эффективности гидролиза, определяемой величиной kcat/KM, на порядок превосходят хромогенные субстраты, причем для всех изученных ферментов, за исключением катепсина L, Glp-Phe-Ala-AMC и Glp-Phe-Ala-AFC расщеплялись гораздо лучше, чем Abz-Ala-Phe-pNA. В случае флуорогенных субстратов kcat/KM была максимальной при гидролизе Abz-Phe-Ala-pNA катепсином L, а в случае хромогенных субстратов – при расщеплении Glp-Phe-Ala-pNA папаином. Наибольшая эффективность гидролиза всех хромогенных субстратов наблюдалась для папаина, а наименьшая – для катепсина L; в случае папаина, фицина и катепсина В наилучшим субстратом являлся Glp-Phe-Ala-pNA; бромелаин с сопоставимой эффективностью гидролизовал также Glp-Val-Ala-pNA; катепсин L лучше всего гидролизовал Z-Ala-Ala-Gln-pNA.
а б
Рис. 4. Эфективность гидролиза флугенных (а) и химогенных (б) субстратов цитированных пептидаз семейства С1. Условий реакции: рН 5,6 1 мМ DTT, 2,5 % DMF, концентрация пептидаз 20–50 нМ, диапазон концентрации флуорогенных субстратов 1,25–75 мкМ, хромогенных субстратов 25–1000 мкМ
4.2. Селективность субстратов цистеиновых пептидаз семейства С1
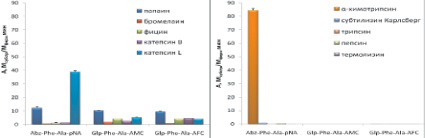
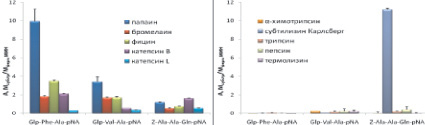
Селективность синтезированных субстратов была исследована с использованием сериновых пептидаз – трипсина, α-химотрипсина, субтилизина Карлсберг; аспартильной – пепсина и металлопептидазы – термолизина. Активность ферментов была измерена в условиях, оптимальных для работы цистеиновых пептидаз: в слабокислой среде и в присутствии восстановителя дитиотреитола. Полученные данные представлены на рис. 5.
Синтезированные нами флуорогенные субстраты Glp-Phe-Ala-AMC и Glp-Phe-Ala-AFC были селективны для цистеиновых пептидаз семейства С1 и не гидролизовались пептидазами других кланов. Субстрат Abz-Phe-Ala-pNA расщеплялся химотрипсином с высокой скоростью и, следовательно, селективным не являлся (рис. 5, а–б).
Среди хромогенных субстратов селективными являются Glp-Phe-Ala-pNA и Glp-Val-Ala-pNA. Субстрат Z-Ala-Ala-Gln-pNA расщеплялся субтилизином Карлсберг (рис. 5, в–г).
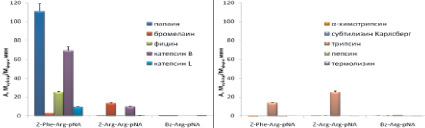
Была исследована также селективность распространенных коммерческих хромогенных субстратов Z-Phe-Arg-pNA (VII), Z-Arg-Arg-pNA (VIII), Bz-Arg-pNA (IX), которые в настоящее время широко используются для тестирования ферментативной активности цистеиновых пептидаз семейства С1. Z-Phe-Arg-pNA (VII) является специфичным субстратом для всего семейства цистеиновых пептидаз семейства С1, Z-Arg-Arg-pNA (VIII) позволяет разделить по активности катепсины В и L, а Bz-Arg-pNA (IX) является самым распространенным субстратом для определения активности цистеиновых пептидаз семейства С1. Для сравнения проводили гидролиз коммерческих субстратов (VII)-(IX) использованными в работе цистеиновыми пептидазами и перечисленными выше пептидазами других кланов (рис. 5, д–е). Z-Phe-Arg-pNA хорошо расщеплялся всеми исследованными цистеиновыми пептидазами, причем наибольшую активность проявлял папаин. Субстрат Z-Arg-Arg-pNA расщеплялся бромелаином и катепсином В, а Bz-Arg-pNA гидролизовался всеми цистеиновыми пептидазами, но с низкой скоростью.
Таким образом, все коммерческие субстраты не являются селективными, т.к. с высокой скоростью расщепляются трипсином.
4.3. Постэлектрофоретическая детекция активности папаина с использованием синтезированных субстратов
Выявленные преимущества синтезированных флуорогенных субстратов Glp-Phe-Ala-AMC и Glp-Phe-Ala-AFC позволили разработать высокочувствительный экспресс-метод детекции активности цистеиновых пептидаз после нативного электрофореза в ПААГ.
а б
в г
д е
Рис. 5. Активность цистеиновых пептидаз семейство С1 и пептидаз других каналов при гидролизе исследуемых субстратов. Условий реакции: рН 5,6 1 мМ DTT, 2,5 % DMF, концентрация пептидаз 20–100 нМ, диапазон концентрации флуорогенных субстратов 25 мкМ, хромогенных субстратов 200 мкМ
Активность пептидаз в геле детектировали визуально под УФ-светом. На рис. 6 представлены результаты детекции папаина в геле (в диапазоне 9–174 пмоль) с использованием предложенного подхода в сравнении с другими способами детекции. На полосе А показаны результаты визуализации фермента при окраске геля кумасси, ниже – детекция папаина с использованием хромогенного субстрата Glp-Phe-Ala-pNA (I). Этот метод обнаружения фермента – непрямой и включает наложение на гель мембраны, пропитанной субстратом, с последующим диазотированием выделяющегося п-нитроанилина. На полосах В и Г показаны результаты визуализации папаина с использованием синтезированных нами Glp-Phe-Ala-AMC (IV) и Glp-Phe-Ala-AFC (V). В отличие от использования хромогенного субстрата Glp-Phe-Ala-pNA, применение флуорогенных соединений (IV) и (V) позволяет детектировать активность непосредственно в геле без проведения дополнительных операций. Преимуществом этого подхода является также повышение чувствительности детекции и возможность безошибочной локализации в геле белковой полосы для дальнейшего анализа.

Рис. 6. Различные способы детекцации патаина после нативного электрофареза в ПААГ
5. Идентификация и характеристика цистеиновых пептидаз Tenebrio molitor
5.1. Фракционирование пептидаз Tenebrio molitor
Синтезированные нами субстраты оказались незаменимы и очень эффективны при исследовании цистеиновых пептидаз личинок жука-вредителя зерновых и крупяных запасов большого мучного хрущака T. molitor (Coleoptera:Tenebrionidae). Отличительной чертой этих ферментов является их высокая нестабильность, обусловленная как их склонностью к автолизу, так и нахождением в составе многокомпонентного пищеварительного комплекса T. molitor. Представление о сложном составе пищеварительного комплекса этого насекомого иллюстрируют результаты хроматографического разделения методом гель-фильтрации экстракта пищеварительных ферментов (рис. 7). В составе комплекса выявлены цистеиновые пептидазы по субстратам Glp-Phe-Ala-pNA и Z-Ala-Ala-Gln-pNA, трипсиноподобные – по Вz-Arg-pNА, химотрипсиноподобные – по Glp-Ala-Ala-Leu-pNA, пролилкарбоксипептидаза по – Z-Ala-Pro-pNA, дипептидилпептидаза IV – по Ala-Pro-pNA, а также ряд других экзопептидаз.
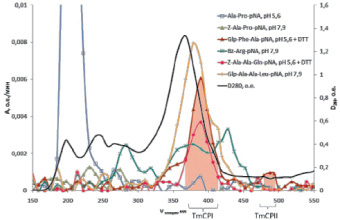
Рис. 7. Фракционирование экстрата пищеварительных пептидаз личинок Tenebrio molitor на колонке с SephadexG-100, элюция 0,01 М фосфарным буфером, рН 5,6, содержащим 0,5 М NaCl
В связи с этим использование синтезированных нами селективных субстратов являлось необходимым залогом успеха в детектировании и идентификации цистеиновых пищеварительных пептидаз T. molitor. На рис. 8 приведены профили элюции пептидаз, тестированных по синтезированному нами Glp-Phe-Ala-pNA и коммерческому субстрату цистеиновых пептидаз Z-Phe-Arg-pNA в условиях, оптимальных для работы цистеиновых пептидаз (рН 5,6, 1 мМ DТТ) и трипсиноподобных пептидаз (pH 7,9, без DТТ). Видно, что активность по субстрату Glp-Phe-Ala-pNA детектировалась только в условиях, оптимальных для работы цистеиновых пептидаз, в пиках TmCPI и TmCPII. Активность по субстрату Z-Phe-ArgpNA проявлялась в обоих рассматриваемых условиях, а также в большем количестве фракций, которые соответствовали элюции не только цистеиновых, но и трипсиноподобных пептидаз. Таким образом, только использование предложенных в нашей работе селективных субстратов позволило однозначно выявить активность цистеиновых пептидаз в столь сложной природной смеси, как пищеварительный комплекс личинок T. molitor.
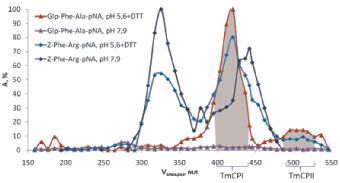
Рис. 8. Использование синтезированого субстрата Glp-Phe-Ala-pNA в сравнений с коммерческим Z-Phe-Arg-pNA для выявления цистеиновых пептидаз при фракционировании экстракта пищеварительных ферментов личинок T. Molitor на колонке с SephadexG-100. Условия эксперимента аналогично рис. 7
5.2. Идентификация цистеиновых пептидаз Tenebrio molitor
Нами были предприняты многочисленные попытки очистить цистеиновые пептидазы TmCPI и TmCPII с помощью ионообменной и гидрофобной хроматографии, ковалентной хроматографии с пиридилдисульфидным сорбентом, а также аффинной хроматографии с использованием в качестве лиганда соевого ингибитора трипсина. Однако все способы и их различные комбинации оказались неэффективными ввиду значительной потери активности пептидаз и невозможности получить очищенные ферменты. В связи с этим мы разработали методику на основе предложенных нами селективных флуорогенных субстратов, позволившую идентифицировать пептидазы T. molitor после всего лишь одной хроматографической стадии очистки. Частично очищенные препараты TmCPI и TmCPII (рис. 7 и 8) подвергали дальнейшему фракционированию посредством нативного электрофореза, после чего непосредственно в геле детектировали активность цистеиновых пептидаз по расщеплению Glp-Phe-Ala-AMC (рис. 9). Флуоресцирующие полосы вырезали из геля и анализировали триптические гидролизаты TmCPI и TmCPII с помощью масс-спектрометрии.
Последовательности некоторых из полученных триптических пептидов были определены методом MS/MS. Чистота полученных ферментных препаратов была показана с помощью электрофореза в денатурирующих условиях. Поиск подходящих аминокислотных последовательностей белков был проведен в базах данных NCBI и предоставленной д-ром Брендой Опперт (США) базой кДНК из кишечников личинок T. molitor. Таким образом, препарат TmCPI был идентифицирован как катепсин В-подобная пептидаза T. molitor (25 кДа).
Препарат TmCPII был идентифицирован как катепсин L-подобная пептидаза (25 кДа), присутствующая в виде близких изоформ, различающихся несколькими аминокислотными заменами.
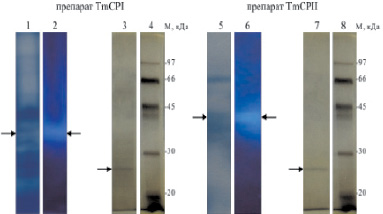
Рис. 9. Электрофоретический анализ TmCPI и TmCPII (показаны стрелками). После нативного электрофареза дорожки 1 и 5 окрашивали Кумасси G-250 для визуализации белка. На дорожках 2 и 6 тестировали активность цистеиновых пептидаз с использованием Glp-Phe-Ala-AMC. На дорожках 3 и 7 представлены результаты электрофореза в денатурирующих условиях фракций TmCPI и TmCPII, изолированных из дорожек 2 и 6, соответственно. Дорожки 4 и 8 – маркеры молекулярой массы. Дорожки 3, 4, 7 и 8 окрашивали серебром
5.3. Субстратная специфичность цистеиновых пептидаз T. molitor
Субстратную специфичность идентифицированных пептидаз T. molitor изучали с использованием синтезированных (I)–(VI) и коммерческих (VII)–(IX) субстратов.
Активность TmCPI и TmCPII была определена с учетом титрования активных центров ферментов специфическим необратимым ингибитором Е-64 (L-транс-эпоксисукцинил-лейциламидо(4-гуанидино) бутаном) и измерена в присутствии ингибиторов сериновых пептидаз PMSF (фенилметилсульфонилфторида) и STI (соевого ингибитора трипсина Куница). Обе пептидазы расщепляли все исследуемые субстраты, но с разной эффективностью (рис. 9). Наибольшую активность пептидазы проявляли при гидролизе субстрата Z-Phe-Arg-pNA. С удовлетворительной скоростью расщеплялись хромогенный субстрат Glp-Phe-Ala-pNA и его флуорогенные аналоги Glp-Phe-Ala-AMC и Glp-Phe-Ala-AFC. Катепсин В-подобная пептидаза, как и ее гомолог из млекопитающих, также хорошо расщепляла Z-Arg-Arg-pNA. Специфичность катепсин L-подобной пептидазы из Tenebrio molitor не кореллирует со специфичностью катепсина L млекопитающих (рис. 5).
5.4. Гидролиз аналогов токсических пептидов глиадинов катепсинами из различных источников
В работе были использованы флуорогенные аналоги токсических пептидов глиадинов Abz-LPYPQPQLPQ-EDDnp (X) и Abz-QPQQPFPQ-EDDnp (XI), любезно предоставленные д-ром Луисом Джулиано (Бразилия). Это пептидомиметики с внутримолекулярным тушением флуоресценции (Abz – флуорофор, EDDnp (этилендиамин 2,4-динитрофенил) – тушитель флуоресценции). Поскольку цистеиновые пептидазы TmCPI и TmCPII способны расщеплять пептидные связи после остатка Gln в субстрате Z-Ala-Ala-Gln-pNA (рис. 10), нами было предположено, что они могут расщеплять и токсические пептиды глиадинов. Активность цистеиновых пептидаз T. molitor по субстратам (X) и (XI) была измерена в присутствии ингибиторов сериновых пептидаз PMSF и STI. Для сравнения в этих же условиях был проведен также гидролиз этих субстратов гомологичными пептидазами млекопитающих – катепсинами В и L.
Оказалось, что аналоги токсических пептидов расщеплялись катепсин L-подобными пептидазами и не гидролизовались катепсин В-подобными пептидазами из разных источников (рис. 11). Субстрат (XI) гидролизовался обоими катепсинами L с сопоставимой скоростью, в то время как субстрат (X) расщеплялся в 5 раз эффективнее пептидазой TmCPII. Таким образом, пищеварительная цистеиновая пептидаза TmCPII из личинок T. molitor может быть предложена в качестве кандидата для создания лекарственного препарата против целиакии.
Как видно из проведенных научных исследований Т.А. Семашко можно сделать следующие выводы:
1. Проведен дизайн и осуществлен химико-энзиматический синтез ряда хромогенных и флуорогенных субстратов цистеиновых пептидаз семейства С1: Glp-Phe-Ala-pNA, Glp-Val-Ala-pNA, Abz-Phe-Ala-pNA, Glp-Phe-Ala-AMC, Glp-Phe-Ala-AFC.
2. Определены кинетические параметры гидролиза синтезированных субстратов пептидазами семейства С1 различного происхождения: растительными ферментами папаином, бромелаином и фицином, а также катепсинами B и L млекопитающих и человека. Показано, что эффективность гидролиза флуорогенных субстратов значительно выше, чем хромогенных.
3. Синтезированные пироглутамилпептиды Glp-Phe-Ala-pNA, Glp-Val-Ala-pNA, Glp-Phe-Ala-AMC и Glp-Phe-Ala-AFC селективны для цистеиновых пептидаз семейства С1 и, в отличие от коммерчески доступных субстратов, не расщепляются пептидазами других кланов.
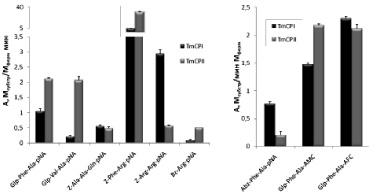
Рис. 10. Субстанция специфичности цистеновых пептидаз T. molitor. Условия реакции: рН 5,6, 1 мМ DТТ, 2,5 % DMF, концентрация хромогенных субстратов 200 мкМ, флуорогенных субстратов 25 мкМ
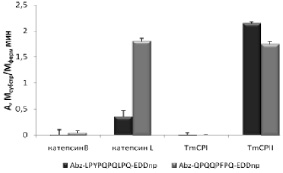
Рис. 11. Гидролиз аналогов токсических пептидов глиадинов катепсин-подобными цистеиновыми пептидазами. Условия реакции: рН 5,6 1 мМ DTT, 2,5 % DMF, концентрация субстратов 25 мкМ
4. Предложен высокочувствительный экспресс-метод детекции цистеиновых пептидаз семейства С1 после нативного электрофореза в ПААГ с использованием синтезированных флуорогенных субстратов Glp-Phe-Ala-AMC и Glp-Phe-Ala-AFC.
5. С использованием синтезированных субстратов идентифицированы и охарактеризованы катепсин В- и катепсин L-подобные пищеварительные цистеиновые пептидазы из личинок большого мучного хрущака Tenebrio molitor.
Более подробно результкаты освещены в научных трудах [7–15, 22].
Фармакологические особенности протеолитических ферментов дынного дерева
Фармакологические особенности. Папаин является протеолитическим ферментом, действие которого напоминает действие пепсина. Заместительная терапия папаином существенным образом улучшает процессы пищеварения в желудочно-кишечном тракте. Исследованиями J.L. Breeling установлено, что папаин проявляет локальное действие в желудочно-кишечном тракте и резорбируется в минимальных количествах, что предотвращает негативное побочное действие на внутренние органы, особенно на печень. Папаин разрушает токсины многих возбудителей инфекционных заболеваний, в том числе столбняка. Противомикробные свойства проявляет содержащийся в латексе дынного дерева лизоцим, который гидролизирует Я-1,4-связи между остатками N-ацетилмурамовой кислоты и 2-ацетамидо-2-дезокси-D-глюкозы и таким образом разрушает пептидогликан (муреин) – основной компонент клеточной стенки бактерий. Наибольшей чувствительностью к лизоциму характеризуются граммположительные микроорганизмы.
Папаин проявляет антикоагулянтные (фибринолитические) свойства, обладает способностью активировать плазминоген (профибринолизин), вследствие чего последний превращается в плазмин (фибринолизин), расщепляющий фибрин. Фибринолитическое действие папаина более мягкое по сравнению с трипсином. Папаин ускоряет заживление ран, трофических язв, пролежней, способствуя их очищению от некротических масс. При лечении экспериментальных ран у морских свинок и мышей он сокращает продолжительность воспалительной фазы раневого процесса, ускоряет очищение раны от патогенной микрофлоры (стафилококков), создает оптимальные условия для репаративных процессов. Папаин стимулирует переваривание нежизнеспособных белковых масс, но вместе с тем является безопасным для жизнеспособных тканей в связи с присутствием в них ингибиторов протеаз. Тем не менее при самостоятельном применении папаин малоэффективен, поскольку для проявления переваривающей функции требуется активатор. Поэтому в препаратах, применяемых в хирургической практике, папаин часто сочетают с цистеином (донором сульфгидрильных групп) или мочевиной, которая обеспечивает активацию сульфгидрильных групп, находящихся в поврежденных нежизнеспособных тканях, но не всегда доступных. Кроме того, мочевина содействует денатурации нежизнеспособных белковых масс и таким образом делает их более чувствительными к ферментативному перевариванию. В эксперименте доказано, что комбинация папаина с мочевиной обеспечивает более сильное (почти вдвое) переваривание телятины в сравнении с чистым папаином. В экспериментальной травматологии продемонстрировано положительное влияние папаина на заживление травматических повреждений. Введение этого фермента в виде препарата «Лекозим» в зону перелома позвонка и лучевой кости кролей содействует лизису некротических структур и созданию условий для ангиогенеза и остеогенеза. При экспериментальных эрозиях роговицы у кроликов инстиляция 0,5–1 % раствора папаина ускоряет процесс эпителизации. Действие на слизистую оболочку конъюнктивы кроликов и ротовой полости человека 10 % раствора папаина (что в 10 раз превышает лечебные дозы) проявляется в кратковременном слущивании поверхностных пластов эпителия, которые быстро регенерируются без дальнейших последствий. Папаин и млечный сок папайи проявляют также противогельминтные свойства [23].
Папаин широко применяется в биологических и биомедицинских научных исследованиях и в биотехнологии, незаменим при исследовании рецепторного аппарата клеток, структуры белков, при химическом анализе и очистке различных биологически активных веществ. Классическими стали исследования структуры иммуноглобулинов путем их ограниченного протеолиза папаином, проведенные Нобелевскими лауреатами G.M. Edelman (нар. 1929) и R.R. Porter (1917–1985). С помощью папаина получают блокирующие F(ab)2-фрагменты моноклональных антител, которые нашли применение как в экспериментальной, так и в клинической медицине [23].
Папаин входит в состав полиэнзимных препаратов, содержащих естественные ферменты растительного и животного происхождения. В последнее время они нашли широкое применение в клинической практике как лекарственные средства, влияющие на разные звенья метаболизма. Новым направлением клинического применения ферментных препаратов является метод системной энзимотерапии. Он базируется на комплексном влиянии на гомеостаз специально подобранных комбинаций гидролитических ферментов животного и растительного происхождения. Экспериментальные исследования свидетельствуют, что полиэнзимные препараты более эффективны в сравнении с моноэнзимными.
Фармакологические свойства полиэнзимных препаратов обусловлены их влиянием на разные процессы, обеспечивающие гомеостаз. Они улучшают реологические свойства крови, обладают противовоспалительным, некролитическим, обезболивающим, фибринолитическим и иммуномодулирующим действием, улучшают региональную микроциркуляцию и регенеративные процессы.
Гемореологическое действие полиэнзимных препаратов обусловлено угнетением агрегации тромбоцитов (антитромботический эффект), повышением фибринолитической активности, уменьшением временного периода спонтанного фибринолиза за счет активации плазминогена, увеличением эластичности (флексибельности) эритроцитов, снижением адгезии форменных элементов крови к сосудистой стенке [2–5, 15–23].
Противовоспалительное действие энзимных препаратов обусловлено влиянием на иммунные и неиммунные механизмы воспаления. Ферменты разрушают медиаторы воспаления, в том числе простагландины, лизоцим, гаптоглобин, брадикинин, С-реактивный белок, а также влияют на разные звенья процесса воспаление (метаболизм арахидоновой кислоты, системы комплемента, кининов и факторы свертывания крови). Инактивация медиаторов воспаления предопределяет обезболивающий эффект. Энзимные препараты расщепляют плазматические белки, которые проникают при остром воспалении в соединительную ткань, облегчают элиминацию белкового детрита и депозитов фибрина из зоны воспаления, что обеспечивает улучшение микроциркуляции в зоне повреждения и уменьшение локального отека. Поддерживая физиологический процесс ликвидации воспаления, энзимные препараты препятствуют переходу его в хроническую форму. Кроме того, они повышают локальную концентрацию антибиотиков в тканях и содействуют их проникновению в очаг воспаления, способны потенцировать и пролонгировать действие антибиотиков. Доказана способность энзимных препаратов улучшать переносимость полихимиотерапии при онкологической патологии.
Полиэнзимные препараты проявляют иммуномодулирующее действие. Их влияние на иммунную систему заключается прежде всего в модификации иммунного ответа за счет стимуляции иммунокомпетентных клеток, регулирующего действия на молекулы межклеточной адгезии (IСАМ-1, LFА и др.) и иммуносупрессивные механизмы, разрушении и противодействии образованию иммунных комплексов. Основными механизмами иммуномодулирующего действия энзимных препаратов является: стимуляция фагоцитоза, повышение цитотоксичной активности макрофагов, активация в 8–100 раз NК-клеток (естественных киллеров), индукция синтеза цитокинов (фактора некроза опухолей – TNF, интерлейкина-1), угнетение активации комплемента и уменьшение индуцированных ним повреждений, элиминация фиксированных в тканях иммунных комплексов, предотвращение образования новых иммунных комплексов, участие в разрушении циркулирующих иммунных комплексов, влияние на аутоиммунные процессы через систему Т-хелперов.
Подробно изучена фармакокинетика полиэнзимного препарата «Вобэнзим», в состав которого входит папаин. После приема внутрь энзимы всасываются в тонком кишечнике в активной форме, сохраняя гидролитическую активность. Всасывание в тонком кишечнике некоторых ферментов достигает 20 %. В крови макромолекулы энзимов связываются с антипротеазами α1-антитрипсином и 2-макроглобулином. Благодаря этому экранируются антигенные детерминанты протеаз, которые не вызывают сенсибилизацию организма. Максимальная концентрация компонентов полиэнзимных препаратов достигается через 2 часа, поддерживается на стабильном уровне в течение 4 часов, а потом снижается в течение 2 часов. Период полувыведения составляет 8 часов. Энзимы, циркулирующие в крови, частично захватываются звездчатыми ретикулоэндотелиоцитами печени и другими клетками системы мононуклеарных фагоцитов. Около 10 % препарата выводится с мочой, около 45 % – с калом. Препарат, не абсорбировавшийся вкишечника, участвует в процессах пищеварения.
При экспериментальной алиментарной гиперхолестеринемии кроликов подтверждено, что препарат «Вобэнзим» проявляет выраженное гиполипидемическое и антиатерогенное действие. Наряду со снижением уровня холестерина сыворотки он тормозит в 2,8–3,2 раза интенсивность захвата липопротеидов плазмы культурой мышинных макрофагов. Предотвращение резкого повышения атерогенности плазмы связывают со снижением интенсивности процессов перекисного окисления липидов (замедлялось увеличение концентрации малонового диальдегида в плазме и моноцитах, повышалась скорость снижения индуцированной хемилюминесценции) при сохранении активности антиоксидантных ферментов (каталазы), снижением активности моноцитов.
В опытах in vitro полиферментный препарат «Вобэ-Мугос» нейтрализует инфекционную активность вирусов полиомиелита и осповакцины в культурах клеток мышей, НeLa и амниона человека, а также вируса табачной мозаики при экспериментальном инфицировании растений [2–5, 15–23].
Доказаны противоопухолевые свойства комбинированных энзимных препаратов. При общем культивировании эксплантатов нормальной и раковой ткани установлено, что препараты проявляют выборочное цитолитическое действие только на трансформированные клетки. На животных доказаны антиметастатические свойства препарата «Вобэ-Мугос».
Химопапаин гидролизирует неколлагеновые полипептиды и белки, поддерживающие третичную структуру хондромукопротеина. Уменьшение осмотической активности и абсорбции жидкости приводит к снижению внутридискового давления, уменьшению компрессии, следовательно, и болей в пояснице. Этот механизм действия установлен в опытах на животных in vitro и in vivo. В экспериментах на взрослых собаках через 48 часов и 14 дней после введения химопапаина в поясничный межпозвоночный диск с помощью радиографии выявлено сужение межпозночного пространства. При патологоанатомическом исследовании собак на 14-й день эксперимента наблюдалась кавитация пульпозного ядра. Химопапаин растворяет пульпозное ядро собак и кроликов в дозе 100 и 50 пКат единиц на диск соответственно. Опытами in vitro доказано, что химопапаин гидролизирует белково-мукополисахаридный комплекс пульпозного ядра межпозвоночного диска человека, но не действует на его коллагеновые структуры.
Экстракты эпикарпа, эндокарпа и семян как неспелых, так и спелых плодов папайи обладают выраженной бактериостатической и бактерицидной активностью в отношении Staphylococcus aureus, Bacillus subtilis, Enterobacter cloacae, Escherichia coli, Salmonella typhi, Shigella flexneri, Proteus vulgaris, Pseudomonas aeruginosa и Klebsiella pneumoniae (Emeruwa A.C., 1982; Osato J.A. etc., 1993). МIС для граммотрицательных бактерий составляет 0,2–0,3 мг/мл, для граммположительных – 1,5–4 мг/мл. Установлено, что антибактериальные вещества плодов папайи имеют белковую природу. Сведения о противомикробных свойствах экстракта листьев папайи довольно противоречивы: J.A. Osato etc. (1993) и C.A. Jimenez Misas etc. (1979) указывают на антибиотическую активность экстракта листьев, а A.C. Emeruwa (1982) – отрицает ее.
Экстракт спелых семян папайи обладает противоамебными свойствами (МІС < 100 мкг/м) (Tona L. etc., 1998).
In vitro препарат папайи проявляет выраженную противогельминтную активность в отношении паразита птиц Ascaridia galli, причем активность превосходит действие пиперазина гексагидрата (Lal J. etc., 1976). Латекс папайи (2–8 г/кг в виде водной суспензии per os на протяжении 22 дней) проявляет дозозависимые антигельминтные свойства при естественном аскаридозе свиней (Satrija F. etc., 1994), оксиуридозе мышей (Mehta R.K. и Parashar G.C., 1966), экспериментальной инвазии мышей интестинальными нематодами Heligmosomoides polygyrus (Satrija F. etc., 1995).
Латекс папайи угнетает рост дрожжеподобных грибов Candida albicans при добавлении в культуру в экспоненциальной фазе роста. Полное угнетение роста грибов наблюдается при концентрации белка около 138 мкг/мл (Giordani R. etc., 1996). Из латекса выделено 2 фермента – a-D-маннозидаза и N-ацетил-b-D-глюкозаминидаза, которые, особенно первый, угнетают рост грибов Candida, а в комбинации их действие потенцируется. Фунгистатический эффект обусловлен разрушением клеточной стенки грибов, поскольку после обработки ферментами латекса она теряет полисахариды в поверхностном слое (а при применении N-ацетил-b-D-глюкозаминидазы – и во внутреннем) (Giordani R. etc., 1991). В дозе 0,41 мг белка/мл латекс вдвое потенцирует противогрибковую активность флуконазола в отношении Candida albicans (Giordani R. etc., 1997). Как установлено с помощью электронной микроскопии, в основе этого синергического эффекта лежит частичное повреждение клеточной стенки грибов.
Экстракт латекса папайи обладает утеротоническими свойствами, максимально проявляющимися на поздних сроках беременности крыс, которая коррелирует с пиковым уровнем эстрогенов в плазме крови (Cherian T., 2000). Не беременная матка крыс также проявляет чувствительность к экстракту латекса. Предшествующая экспозиция ткани матки с феноксибензамином неконкурентно блокирует эффект экстракта, а блокада рецепторов 5-гидрокситриптамина метисергидом частично угнетает утеротоническую активность. Ингибитор циклооксигеназы индометацин на этот процесс не влияет. Эксперименты со стабилизатором тучных клеток кромогликатом исключают опосредованность утеротонического эффекта экстракта латекса дегрануляцией тучных клеток и их медиаторами (гепарином, биогенными аминами, простагландинами). Очищенный папаин в небольших дозах вызывает кратковременное сокращение мускулатуры матки, а в высоких – его энзиматическое влияние испытывают рецепторные белки. Таким образом, утеротонические свойства экстракта латекса обусловливаются комплексом ферментов, алкалоидов и других веществ, влияющих на a-адренорецепторы матки.
Неспелые семена папайи при пероральном введении крысам в дозе 100 мг/кг на протяжении 8 недель вызывают дегенеративные изменения в герминативном эпителии яичек, уменьшение количества клеток Лейдига. Наблюдалось опустошение трубочек придатков яичек, обнаруживались дегенеративно измененные сперматозоиды (Udoh P. и Kehinde A., 1999). Аналогичное действие проявляет водный экстракт семени папайи при пероральном и внутримышечном введении (Chinoy N.J. и George S.M., 1983; Lohiya N.K. etc., 1994). Результаты исследований указывают на то, что вещества с антисперматогенными свойствами локализуются в хлороформном экстракте семени папайи, в частности в бензольной хроматографической фракции и этилацетатной субфракции (Lohiya N.K. etc., 1992, 1999, 2000). При пероральном введении кролям в дневной дозе 50 мг на животного в течение 150 дней бензольная фракция экстракта уже на 15-й день эксперимента индуцировала азооспермию, которая сохранялась на протяжении всего периода исследования. При этом гематологические параметры, концентрация тестостерона в крови, масса яичек, придатков яичек, семенных пузырьков, простаты и уровень фруктозы, глицерофосфохолина, кислой фосфатазы и лактатдегидрогеназы в плазме спермы оставались нормальными, не изменялось либидо животных, но они были бесплодными. У кролей наблюдалось угнетение подвижности сперматозоидов, олигоспермия и повышение процента аномальных сперматозоидов при минимальных изменениях пролиферативных процессов в яичках. На протяжении 60 дней после отмены препарата жизнеспособность спермы кролей восстанавливалось. Исследование in vitro подтверждают, что этилацетатная субфракция хлороформного экстракта семени папайи угнетает подвижность сперматозоидов животных и человека (Lohiya N.K. etc., 2000). При этом движение сперматозоидов человека через 20–25 минут экспозиции полностью прекращалось. С помощью сканирующей и трансмиссионной электронной микроскопии доказано, что биологически активные вещества экстракта семян папайи приводят к повреждению цитоплазматической мембраны в головке и шейке сперматозоидов. Тест на жизнеспособность и анализ числа аномальных сперматозоидов показывают, что после инкубации они становятся бесплодными. Эффект является спермицидным и необратимым. Водный экстракт семени контрацептивными свойствами не обладает. Таким образом, биологически активные вещества семян папайи могут рассматриваться как перспективное контрацептивное средство обратимого действия для мужчин, мишенью которого являются сперматозоиды.
Методом электронно-спинорезонансной спектрометрии доказано, что экстракты эпикарпа, эндокарпа и семени плодов папайи действуют как эффективные скавенджеры радикалов супероксида (ІС50 2,1; 10,0 и 8,7 мг/мл соответственно); проявляют также супероксиддисмутазную активность (соответственно 32, 98 и 33 ед./мл). В качестве возможных антиоксидантных компонентов папайи рассматриваются витамин С, глюкоза, малатная и лимонная кислоты (Osato J.A. etc., 1993). Выраженные антиоксидантные свойства сохраняются и в продуктах дрожжевой ферментации папайи, входящих в состав пищевой добавки Bio-Normalizer (Bio-catalyzer № 11). Методом электронно-спинового резонанса доказано, что в концентрации 50 мг/мл продукты дрожжевой ферментации папайи поглощают 80 % гидроксильных радикалов, образовавшихся в ходе реакции Фентона (IC50 12,5 мг/мл). Bio-Normalizer эффективно угнетает образование свободных радикалов кислорода в бесклеточной среде (в реакции Фентона, в системах ксантин/ксантиноксидаза, перекись водорода/пероксидаза хрена, перекись водорода/гидрохлорид/пероксидаза хрена), а также частично уменьшает спонтанную и стимулированную менадионом продукцию аниона супероксида в эритроцитах. Одновременно он усиливает безвредную внутриклеточную продукцию аниона супероксида как неактивированными, так и активированными нейтрофилами периферической крови человека и перитонеальными макрофагами крыс (Osato J.A. etc., 1995). Кроме того, он дозозависимо усиливает индуцированные интерфероном-g (IFN-g) продукцию оксида азота, фактора некроза опухолей b (TNF-b) и интерлейкина-1b (IL-1b) макрофагами мышей RAW 264.7 (Kobuchi H. и Packer L., 1997). Пероральное введение ферментированного препарата папайи крысам в течение 4 недель уменьшает накопление липидных перекисей в коре головного мозга и угнетает формирование эпилептиформных очагов под влиянием внутрицеребрального введения солей железа. При этом в коре мозга и гипокампе повышалась активность супероксиддисмутазы (Santiago L.A. etc., 1991, Imao K. etc., 1998). В связи с этим препарат имеет перспективы для применения с целью профилактики неврологических нарушений, обусловленных старением и влиянием свободных радикалов.
Латекс неспелых плодов папайи проявляет терапевтический эффект при экспериментальной язве желудка крыс, значительно снижает желудочную секрецию, индуцированную внутривенной инфузией гистамина. Аналогичным эффектом обладает очищенный папаин (Chen C.F. etc., 1981). Экстракты папайи обладают терапевтическим эффектом при экспериментальной желтухе, вызванной у крыс введением сапонозидов Brenanis brieyi (Boum B. etc., 1978). Карпаин, выделенный из листьев папайи, тонизирует сердечную деятельность.
Неочищенный этанольный экстракт неспелых плодов папайи проявляет выраженный гипотензивный эффект у крыс с гипертензией, вызванной дезоксикортикостероном и солевой нагрузкой. Вазорелаксирующие свойства этого экстракта подтвердили исследования in vitro на полосках аорты, почечных и мозговых артериях кролей (Eno A.E. etc., 2000). Поскольку гипотензивное действие исследуемого экстракта не проявлялось на фоне предшествующего введения животным пропранолола, а вазорелаксирующему эффекту противодействует фентоламин, авторы делают вывод о a-адреноблокирующей активности компонентов этого экстракта.
Технико-экономические показатели возделывания дынного дерева в Туркменистане
Протеолитические ферменты дынного дерева обладают высокой коммерческой стоимостью (табл. 2). Например, по каталогу «Sigma» за 2015 год; 1 грамм высокоочищенного папаина стоил – 879.0 Евро (EUR), 250 UN химопапаина – 255.0 (EUR). В связи с этим остро стоит вопрос о решении этой проблемы своими силами и средствами.
Традиционное тепличное хозяйство является весьма энергоемким, затраты на технический обогрев составляют 40–65 % себестоимости продукции, поэтому при проектировании теплично – парникового хозяйства первостепенное внимание следует уделять выбору наиболее рациональных источников технического обогрева, обосновывая его технико-экономическими расчетами.
Теплую воду (30–70 °С), получаемую в результате производственного процесса на заводах и тепловых электростанциях, приходится специально охлаждать в градирнях или брызгальных бассейнах, для того, чтобы ее можно было снова использовать. Огромное количество тепловой энергии, которая могла бы пойти на обогрев сооружения защищенного грунта, теряется при этом безвозвратно. На тепловых и атомных электростанциях около 50–55 %: теплоты уносятся охлаждающей водой конденсаторов турбин. Следовательно, для тепловой станции мощностью 1 млн кВт потери теплоты в конденсаторах турбин составляют около 15 млн ГДж в год, что эквивалентно 500 тыс. т условного топлива. Значительным источником тепловых сбросов являются тепловые электростанции, нефтеперерабатывающие, химические предприятия [2–5, 15–21]. Анализ агрометеорологических факторов аридной экосистемы, влияющих на микроклимат солнечных теплиц для выращивания дынного дерева по регионам Туркменистана: северный – Конеургенч; восточный – Туркменабад; центральный – Ашгабат; юго – западный – Етрек, свидетельствует о том, что для поддержания комфортного температурного режима (18–22 °С) зимой необходимо количество тепловой энергии по регионам страны; в Конеургенчском 467,3–968,76 МДж; в Туркменабатском 131,4–342,0 МДж; в Ашгабатском 83,5–106,2 МДж; в Етрекском 21,1–0000 МДж [2–9].
Следовательно, с 1га можно добывать 45000 г или 45 кг млечного сока. В одном грамме млечного сока содержится: 10 % – папина (45 кг); 16 % – лизоцима (472 кг); 50 % – химопапаина (225 кг); 24 % – пептидаы (108 кг). Соответственно с ценами указанные в табл. 2 можно получить из: папаина – 39 555 000 евро, химипапаина – 162 225 евро; лизоцима – 24 827,2 евро; пептдазы – 2 310 336 евро. Итого получается: 42 052 388,2 евро.
Технико-экономические показатели теплицы Израильского производства площадью 1 га для выращивания дынного дерева и получения млечного сока приведены в табл. 3.
Технико-экономические показатели, подтверждают возможность интродукции возделывания в аридной экосистеме, а также несомненную перспективность и экономическую рентабельность дынного дерева в условиях Туркменистана в условия защищенного грунта с использованием возобновляемых источников энергии и промышленных тепловых отходов при этом себестоимость 1 грамма продукта обходится – 2,21 евро.
Таблица 2
Стоимость высокоочищенных протеолитических ферментов дынного дерева по каталогу «Sigma» за 2015 год
|
Артикул-Pack Размер |
Наличие |
Цена (EUR) |
|
Высокоочищенного: папаина |
||
|
Р4762 – 50 мг |
Расчетное 17.06.2015 Доставка – ОТ |
85.00 |
|
Р4762 – 100 мг |
Расчетное 17.06.2015 Доставка – ОТ |
146.50 |
|
Р4762-1G |
Расчетное 17.06.2015 Доставка – ОТ |
879.00 |
|
Химопапаина |
||
|
C8526-1KU |
Расчетное 17.06.2015 Доставка – ОТ |
721.00 |
|
C8526-250UN |
Расчетное 17.06.2015 Доставка – ОТ |
255.00 |
Таблица 3
Технико-экономические показатели теплицы для выращивания дынного дерева и получения млечного сока с площадью 1 га
|
№ п/п |
Экономические показатели |
Сумма в евро |
|
1. |
Капиталовложения |
18 042 388,2 |
|
2. |
Общее количество добываемого млечного сока в год из плодов в граммах |
450 000 |
|
3. |
Общая выручка |
42 052 388,2 |
|
4. |
Эксплуатационные расходы В том числе: амортизационные отчисления текущий ремонт зарплата топливо на обогрев расходы на удобрение прочие не предвиденные расходы Итого: |
285 057,32 108 259,2 54 129,6 52 325,28 54 129,6 7578,44 8635,2 2089377,32 |
|
5. |
Прибыль в год |
39 963 010,88 |
|
6. |
Себестоимость 1 грамм |
2,21 |
|
7. |
Срок окупаемости (год) |
2,5 |
Традиционное тепличное хозяйство является весьма энергоемким, затраты на технический обогрев составляют 40–65 % себестоимости продукции, поэтому при проектировании теплично – парникового хозяйства первостепенное внимание следует уделять выбору наиболее рациональных источников технического обогрева, обосновывая его технико – экономическими расчетами.
Теплую воду (30–70 °С), получаемую в результате производственного процесса на заводах и тепловых электростанциях, приходится специально охлаждать в градирнях или брызгальных бассейнах, для того, чтобы ее можно было снова использовать. Огромное количество тепловой энергии, которая могла бы пойти на обогрев сооружения защищенного грунта, теряется при этом безвозвратно. На тепловых и атомных электростанциях около 50–55 %: теплоты уносятся охлаждающей водой конденсаторов турбин. Следовательно, для тепловой станции мощностью 1 млн кВт потери теплоты в конденсаторах турбин составляют около 15 млн ГДж в год, что эквивалентно 500 тыс. т условного топлива. Значительным источником тепловых сбросов являются тепловые электростанции, нефтеперерабатывающие, химические предприятия.
Исходя из научного аналитического анализа учитывая биологическую активность, физико-химические свойства, фармакологическую особенность дынного дерева, а также технико-экономические показатели и природно-климатические условия аридной экосистемы, пришли к выводу о необходимости подбора конструкции гелиотеплиц для ее выращивания создания микроклимата с использованием возобновляемых источников энергии и промышленных тепловых отходов в Туркменистане.
Библиографическая ссылка
Пенджиев А.М., Абдуллаев А. ФАРМАКОЛОГИЧЕСКИЕ ОСОБЕННОСТИ МЛЕЧНОГО СОКА ДЫННОГО ДЕРЕВА // Научное обозрение. Медицинские науки. – 2017. – № 1. – С. 36-56;URL: https://science-medicine.ru/ru/article/view?id=959 (дата обращения: 20.04.2024).
 science-review.ru
science-review.ru