Во всем мире, в том числе и в Республике Казахстан, рак молочной железы (РМЖ) является одной из приоритетных форм злокачественных новообразований, стабильно занимая первое место в структуре злокачественных опухолей женщин. В 2018 г. в Республике Казахстан было выявлено 4648 человек с диагнозом «рак молочной железы». Количество ежегодно выявляемых случаев РМЖ в 2014 г. составило 4142, прирост за период наблюдения составил 12,2 %. Смертность от РМЖ на 2018 г. составила 8,2 случаев на 100 000 населения, а 5-летняя выживаемость достигла 54,2 % [1].
Число больных РМЖ с запущенными стадиями составляет большую часть впервые выявленных случаев, что является значительным препятствием для полноценного лечения. Однако в большинстве развитых стран мира число больных РМЖ с ранними стадиями также увеличивается, что связано с ранней диагностикой и проведением скрининговых мероприятий. Установление диагноза на ранних стадиях способствует проведению органосохранного лечения [2, 3]. В данном направлении в последние годы широко начала развиваться интраоперационная лучевая терапия (ИОЛТ) [4]. Некоторыми авторами показано, что повышение уровня радиации после облучения всей груди не влияет на долгосрочную общую выживаемость, но может улучшить местный контроль с наибольшим абсолютным преимуществом у молодых пациентов, хотя и увеличивает риск умеренного и тяжелого фиброза [5, 6]. Дополнительной дозы облучения можно избежать у большинства пациентов старше 60 лет [7, 8].
Цель исследования – изучить показатели общей и безрецидивной выживаемости у пациенток раком молочной железы, получивших интраоперационную лучевую терапию.
Материалы и методы исследования
С 2012 по 2016 г. в Алматинском онкологическом центре были изучены две группы больных. Основная группа больных (n = 67) состояла из больных РМЖ ранних стадий, получивших интраоперационную лучевую терапию (ИОЛТ). В контрольной группе (n = 66) пациентки не получили ИОЛТ. Дизайн исследования был когортный, обсервационный и проспективный. С помощью метода Каплана – Мейера подсчитана общая и бессобытийная (рецидив, смерть) выживаемость. Также подсчитаны средние бессобытийного дожития с 95 % доверительными интервалами (ДИ).
Результаты исследования и их обсуждение
В анализируемую основную группу (с ИОЛТ) вошли больные в возрасте от 28 до 76 лет (средний возраст 54,37 ± 6,52 лет). В контроле средний возраст составил 55,4 ± ± 7,12 лет. Самой старшей пациентке было 78 лет, самой младшей – 37 лет. В основной группе было 55 больных с Ia и IIa стадиями и 12 пациенток с IIb стадией. Контрольная группа состояла из 66 пациенток с аналогичными стадиями (табл. 1).
Таблица 1
Распределение больных РМЖ по стадиям в контрольной и основной группах
|
Группа |
Клиническая стадия (абс., %) |
||
|
Ia |
IIa |
IIb |
|
|
Основная (n = 67) |
28 (41,8 %) |
27 (40,3 %) |
12 (17,9 %) |
|
Контрольная (n = 66) |
26 (39,4 %) |
29 (43,9 %) |
11 (16,7 %) |
|
Всего (n = 133) |
54 (40,6 %) |
56 (42,1 %) |
23 (17,3 %) |
Критериями включения в научное исследование явились: 1) размер опухоли (T) < 2,5 см, отсутствие мультицентричного роста; 2) статус лимфатических узлов (N) – отрицательный или N0 и 3) положительный рецепторный статус опухоли.
Критериями исключения явились: 1) боль- шие размеры опухоли (более 2,5 см); 3) мультицентричный тип роста опухоли; 4) положительный статус лимфоузлов 4) отрицательный рецептурный статус опухоли при ИГХ-исследовании.
Пациентки с ранними формами РМЖ получили различные дозы ИОЛТ. При люминальном типе В, тройном негативном раке и Her 2 neu положительном РМЖ пациентки получили дозу облучения в 12 Гр (n = 35). При люминальном А типе РМЖ пациентки получили дозу в 21 Гр. (n = 32). Для проведения лучевой терапии непосредственно в операционной подводили специальные аппликаторы на место удаленного участка молочной железы (рис. 1). Обычно резекция органа представлялась в виде квадрантэктомии или люмпэктомии.
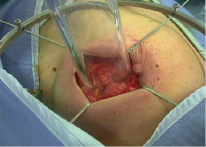
Рис. 1. Наложение аппликатора для проведения интраоперационной лучевой терапии
В контрольной группе больные получили стандартную терапию (операция, химиотерапия и облучение всей груди в послеоперационном периоде). Эти пациентки не получали ИОЛТ. В данной группе в 8 случаях наступил рецидив основного заболевания. Безрецидивная выживаемость у больных РМЖ в контроле составила 88 % (рис. 2).
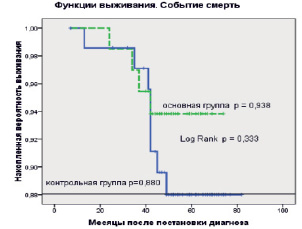
Рис. 2. Оценки Каплана – Мейера общей выживаемости больных раком молочной железы в основной и контрольной группах. Событие: смерть от любых причин. Засечки означают цензурированные данные
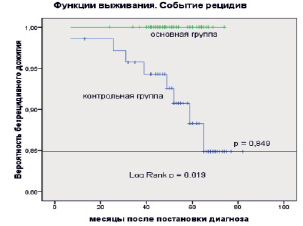
Рис. 3. Оценки Каплана – Мейера безрецидивной выживаемости больных раком молочной железы в основной и контрольной группах. Событие: рецидив. Засечки означают цензурированные данные
На рис. 2 представлены оценки Каплана – Мейера для события «смерть». В основной группе из 67 пациенток на момент завершения срока наблюдения 63 были живы. Четверо пациенток умерли от сопутствующих заболеваний, не от рецидивирования или прогрессирования основного заболевания. Рецидивов заболевания за анализируемый период времени не было зарегистрировано. Таким образом, пятилетняя вероятность выживания, для пациенток в основной группе (с ИОЛТ) составила р = 0,938 (рис. 2).
При этом бессобытийная (безрецидивная) выживаемость в этой группе больных РМЖ составила 100,0 % (рис. 3). Очевидно, что при таком соотношении нецензурированных и цензурированных данных расчет медианы выживаемости невозможен, а расчет среднего времени жизни будет определяться наибольшим временем выживания среди цензурированных данных.
Как видно из рисунка, точечная оценка трехлетней выживаемости в обеих группах одинакова и равна 97 %. Оценки пятилетней выживаемости для основной группы 93,8 % и для контрольной группы 89,3 %. Необходимо также отметить, что эти оценки статистически значимо не различаются (Log Rank p = 0,333). Нет статистически значимых различий и в частоте возникновения события в обеих группах (тест хи-квадрат р = 0,248).
На рис. 3 представлены оценки Каплана – Мейера для события «рецидив».
Как видно из рисунка, в основной группе не было зарегистрировано ни одного рецидива, что и привело к 100 % вероятности безрецидивной выживаемости в течение всего времени наблюдения. Вероятность безрецидивной выживаемости в контрольной группе за весь период наблюдения составила 84,9 %. В данном случае, для безрецидивной выживаемости фиксируются статистически значимые различия между группами (Log Rank p = 0,019).
На рис. 4 представлены оценки Каплана – Мейера для события «смерть или рецидив» для основной и контрольной групп больных.
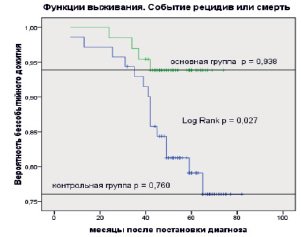
Рис. 4. Оценки Каплана – Мейера бессобытийной выживаемости больных раком молочной железы в основной и контрольной группах. Событие: смерть + рецидив. Засечки означают цензурированные данные
Оценка трехлетнего бессобытийного дожития больных в основной группе (с ИОЛТ) была равна р = 0,969, а в контрольной – р = 0,931. В отношении пятилетнего бессобытийного дожития получены следующие оценки: для основной группы р = 0,939, для контрольной р = 0,791.
Получены статистически значимые различия между временем дожития для основной и контрольной групп (Log Rank p = 0,027), что безусловно говорит о преимуществе ИОЛТ.
Важной особенностью проведенного исследования является большое количество цензурированных данных, что не позволяет рассчитать медиану выживаемости. Оценка же среднего времени выживания ограничивается наибольшим временем выживания цензурированных данных. Отсюда следует, что если бы наблюдения были продолжены, оценка среднего времени выживаемости была бы другой. Тем не менее для иллюстрации полученных данных в табл. 2 представлены оценки среднего времени бессобытийной выживаемости.
Таблица 2
Среднее время бессобытийного дожития для основной и контрольной групп
|
Фактор |
Среднееa |
|||
|
Оценка |
Ст. ошибка |
95 % доверительный интервал |
||
|
Нижняя граница |
Верхняя граница |
|||
|
Контрольная группа |
72,982 |
2,248 |
68,577 |
77,388 |
|
Основная группа |
71,558 |
1,197 |
69,212 |
73,904 |
|
Всего |
75,374 |
1,479 |
72,474 |
78,273 |
a. Оценивание ограничивается наибольшим временем дожития, если оно является цензурированным.
Заключение
Таким образом, результаты проведенных исследований показали, что интраоперационная лучевая терапия является эффективным методом лечения больных раком молочной железы при I–II стадиях. В основной группе больных, получивших сохранную операцию с облучением груди во время хирургической резекции органа, рецидивов заболевания не было, а безрецидивная выживаемость достигла 100 %. В контрольной группе больных, которым не проводилось обучение ложа опухоли во время выполнения сохранной операции, рецидивы возникли в 8 случаях из 66, а безрецидивная выживаемость была равна 84,9 %. В основной группе больных умерло 4 больных, где пациентки умерли не от основного заболевания, а от сопутствующих болезней. Общая выживаемость (71-месячная) в группе больных, получивших облучение во время операции, была равна 93,8 % %. Бессобытийная выживаемость в контрольной группе была равна 74,8 %. При сравнении основной группы с контрольной группой разница была статистически значимой (р < 0,05).
Таким образом, проведение лучевой терапии на ложе опухоли непосредственно во время выполнения сохранной операции больным с ранними стадиями рака молочной железы является эффективным методом лечения и может быть рекомендовано для широкого внедрения в клиническую практику онкомаммологии. Такая методика позволяет контролировать местный рецидив.
Библиографическая ссылка
Куланбаев Е.М., Сорокин А.А., Макимбетов Э.К. ВЛИЯНИЕ ИНТРАОПЕРАЦИОННОЙ ЛУЧЕВОЙ ТЕРАПИИ НА ВЫЖИВАЕМОСТЬ БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ I–II СТАДИИ // Научное обозрение. Медицинские науки. 2021. № 3. С. 45-49;URL: https://science-medicine.ru/ru/article/view?id=1189 (дата обращения: 20.12.2025).
DOI: https://doi.org/10.17513/srms.1189
 science-review.ru
science-review.ru