Анемия – клинико-гематологический синдром, в основе которого лежит тканевая гипоксия, развивающаяся в результате снижения количества гемоглобина в крови [1]. Причиной анемии может быть один из трех факторов или их сочетание: кровопотеря, недостаточное образование эритроцитов или усиленная их деструкция. Среди анемий ведущими являются железодефицитные, составляя в структуре у женщин до 90 % и среди мужчин – до 80 %. Важным является высокая распространенность среди населения латентного дефицита железа, которая колеблется от 19, 5 % до 30 %, кроме того, от 50 % до 86 % женщин имеют факторы риска развития анемии [1, 13].
Железодефицитная анемия (ЖДА) – заболевание системы крови, обусловленное дефицитом железа в организме, сопровождаетcя изменениями параметров его метаболизма, уменьшением концентрации гемоглобина в эритроцитах, количественными и качественными их изменениями и клинически выражается анемической гипоксией и сидеропенией [13]. Сидеропения и развивающаяся в последующем тканевая и гемическая гипоксия приводят к расстройствам сердечно-сосудистой (миокардиодистрофия и нарушение кровообращения различной степени), нервной системы (вегетативно-сосудистые, вестибулярные нарушения, астенический синдром),снижению детородной функции женщин, а также развитие осложнений во время беременности и родов, изменению интеллекта и поведенческих настроений, хронизацию различных заболеваний и как следствие снижение работоспособности и ухудшение качества жизни.
В организме человека содержится 2–6 г железа. К наиболее важным железосодержащим соединениям относятся: гемопротеины, структурным компонентом которых является гем (гемоглобин, миоглобин, цитохромы, каталаза, пероксидаза), ферменты негеминовой группы (сукцинатдегидрогеназа, ацетил-КоА-дегидрогеназа, ксантиноксидаза), ферритин, гемосидерин, трансферрин. Железо входит в состав комплексных соединений и 95 % его количества распределяется между активной формой (в составе гемоглобина) и запасной (в составе ферритина, формирующего депо железа) в соотношении 60: 35 [1].
В суточном рационе взрослого человека в норме должно содержаться 10–15 мг железа, из которого абсорбируется в кишечнике 1–3 мг. Накопление железа осуществляется белками ферритином и гемосидерином. В молекуле ферритина железо локализуется в виде молекул FeOOH или FeO·H2PO4 внутри протеиновой оболочки, состоящей из белка апоферритина, который может поглощать Fe2+ и окислять его до Fe3+. Синтез апоферритина стимулируется железом. Гемосидерин представляет собой деградированную форму ферритина, в которой молекула теряет часть протеиновой оболочки и денатурируется. Большая часть депонированного железа находится в виде ферритина. При необходимости железо может активно освобождаться из ферритина и использоваться для эритропоэза, в то время как из гемосидерина железо освобождается медленно.
Патогенетическое развитие железодефицитного состояния (ЖДС) организма можно условно разделить на несколько стадий [21]:
– прелатентный дефицит железа (недостаточность накопления) – отмечается снижение уровня ферритина и снижение содержания железа в костном мозге, повышена абсорбция железа;
– латентный дефицит железа (железодефицитный эритропоэз) – дополнительно снижается сывороточное железо, повышается концентрация трансферрина, снижается содержание сидеробластов в костном мозге;
– выраженный дефицит железа – собственно железодефицитная анемия – дополнительно снижается концентрация гемоглобина, эритроцитов и гематокрит.
Эволюция синтетических лекарственных средств терапии ЖДА
Фармакотерапия ЖДА базируется на введение в организм железа из состава железосодержащих лекарственных средств. Для обоснованного выбора лекарственных препаратов следует учитывать, что железо всасывается в 2 формах – гемовой (10 %) и негемовой (90 %) через щеточную кайму кишечника. Количество железа, поступаемое в течение суток с пищей, равно приблизительно 10–12 мг железа (гемовое + негемовое), но только 1–1,2 мг (около 10 %) микроэлемента из этого количества абсорбируется [18]. Механизм всасывания железа – активный, посредством специфических белков-переносчиков:
- мобилферрин и b3-интегрин – облегчают всасывание Fe3+;
- двухвалентный транспортер металлов (divalentmetaltransporter, DMT-1) обеспечивает всасывание всех двухвалентных металлов, в т.ч. и Fe2+.
Эти белки обеспечивают поступление железа в энтероциты [15, 45]. Известный факт лучшей усвояемости двухвалентного железа в данной модели объясняется химическими сдвигами кислотно-основного баланса в ЖКТ. Действительно с пищей в организм железо поступает в виде ферро- (Fe2+) и преимущественно ферри-иона (Fe3+), причем и ферро- и ферри-ионы растворимы в кислой среде желудка. При поступлении желудочного содержимого в кишечник рН пищевого комка повышается и в отличие от Fe2+ферри-ион образует нерастворимые соли. В этих условиях только муцин [15], хелатируя железо, способен поддержать ферри-ион в растворимом состоянии. Другой возможностью сохранить растворимость солей трехвалентного железа является восстановление Fe3+ в его закисную (Fe2+) форму посредством ферроредуктазы щеточной каймы [51] или в окислительно-восстановительной реакции в паре с аскорбиновой кислотой (рис. 1).
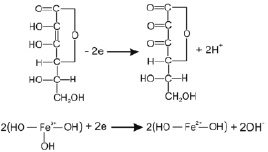
Рис. 1. Окисление ферри-иона аскорбиновой кислотой
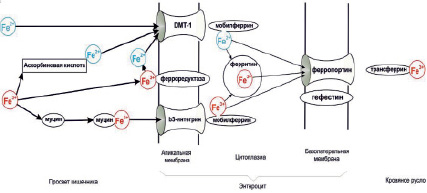
Рис. 2. Схема всасывания ионов железа из кишечника в кровь
В целом механизм транспорта ионов железа из кишечника в кровь схематически может быть представлен в виде (рис. 2).
Транспорт железа из энтероцита осуществляется через базолатеральную мембрану с помощью базолатерального транспортного белка – ферропортина (MTP1 или Ireg1) [50, 53]. Окисление ионов Fe2+ до Fe3+ осуществляется мембранным базолатеральным белком гефестином, а поступающий в кровь ферри-ион связывается с трансферрином.
Железо гема (из состава животных белков) свободно проходит через клетки интестинальной слизистой, внутри гем деградирует под действием специальных ферментов, а железо присоединяется к пулу внутриклеточного белка ферритина [16]. Однако конкретные механизмы транспорта железа в виде соединения гем-железо через эпителий слизистой оболочки кишечника в настоящее время мало изучены [15].
На процессы метаболизма железа и на процесс кроветворения в целом влияют микроэлементов (Mn, Cu и Co), которые вместе с Fe относят к микроэлементам «кроветворного комплекса» [54]. В результате обобщения экспериментальных данных можно выделить следующие биологические функции указанных микроэлементов [28, 29]:
1. Mарганец в биологических системах присутствует в виде ионов Мn2+ или его комплексов с белками, нуклеиновыми кислотами и аминокислотами. Хотя эти комплексы из-за большого радиуса катиона Мn2+ обычно мало устойчивы, они способствуют активации большого числа ферментов разных классов: трансфераз, гидролаз, изомераз. Ионы Мn2+ стабилизируют конформацию нуклеиновых кислот, участвуют в процессах репликации ДНК, синтезе РНК и белка. Таким образом, биогенная функция ионов марганца имеет широкий спектр: оказывает влияние на кроветворение, образование костей, минеральный обмен, рост, размножение и некоторые другие функции. Еще одна особенность иона Мn2+ – универсализм, так как он может выполнять каталитическую функцию подобно Сu2+, Fe2+, Zn2+, но в то же время действовать подобно Mg2+ и Са2+. Катион Мn3+ совместно с Fe3+ входит в состав трансферина, супероксиддисмутазы и кислотной фосфатазы, т.е. в состав типичных металлопротеинов.
2. Кобальт в организме в основном содержится в витамине B12 который является сложным азотсодержащим органическим комплексом Со3+ с координационным числом, равным шести. Витамин B12 необходим для нормального кроветворения и созревания эритроцитов, синтеза аминокислот, белков, РНК, ДНК и других соединений, без которых нормальное развитие организма невозможно.
3. Медь в организме содержится в составе специфического белка плазмы крови – церулоплазмина {ЦПСu2+}. Церулоплазмин катализирует окисление Fe2+ в Fe3+, участвуя тем самым напрямую в кроветворении.
Дефицит меди может привести к разрушению эритроцитов. Эффективность действия микроэлементов, в частности марганца, значительно повышается в комплексе с другими такими микроэлементами как: медь, кобальт, железо [29], что позволяет отнести их к микроэлементам кроветворного комплекса.
Выбору препарата для коррекции сидеропении придается особое значение, т.к. важна не только эффективность, но и отсутствие побочных реакций и осложнений при их применении. Таким образом, соединения железа, которые могут использоваться в составе лекарственных препаратов должны обладать хорошей растворимостью, большим содержанием элементарного железа и малой токсичностью. Для анализа применимости соединений железа, в зависимости от его валентности рассмотрим основные характеристики неорганических соединений железа и его ионов (табл. 1).
Таблица 1
Физические характеристики некоторых неорганических соединений железа [32]
|
Вид иона, заряд иона |
Радиус иона, нм |
Соединение |
Растворимость г в 100 г воды |
Содержание элементарного железа в 1мл раствора, мг |
|
ферро-форма, +2 |
0,080 |
FeSO4 ·7H2O |
26,3 |
52,6 |
|
FeCl2·4H2O |
62,6 |
176,2 |
||
|
Fe3(PO4)2 |
2,0·10-5 |
4,6·10-5 |
||
|
FeCO3 |
6,9·10-5 |
33,3·10-5 |
||
|
Fe(OH)2 |
5,3·10-5 |
33,0·10-5 |
||
|
ферри-форма +3 |
0,067 |
Fe2(SO4)3·9H2O |
440,0 |
878,0 |
|
FeCl3 |
96,9 |
334,3 |
||
|
Fe(OH)3 |
3,1·10-9 |
1,6·10-7 |
Нитратные соединения железа не рассматриваются т.к., хотя сами нитраты не отличаются высокой токсичностью, но под действием микрофлоры кишечника идёт восстановление их в нитриты. Токсическое действие нитритов обусловлено тем, что они связывают двухвалентное железо гемоглобина крови и мешают тем самым нормальному тканевому дыханию[18]. Кроме того, нитриты в организме участвуют в образовании более сложных соединений – нитрозаминов, считающихся канцерогенами.
Из сравнительного анализа соединений железа видно, что соли ферри-иона обладают лучшей растворимостью и большим содержанием элементарного железа. Вместе с тем, ферри-ион имеет большее отношение заряд/радиус иона, чем ферро-ион, что обуславливает значительную степень гидролиза солей железа (III). При гидролизе солей железа (III) происходит образование малорастворимого гидрооксида Fe(OH)3 (рис. 3).
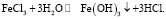
Естественно, что в желудке, где имеется свободная хлористоводородная кислота равновесие реакции по принципу Ле-Шателье сдвинуто влево и ферри-ион находится в ионном виде в растворе. При переходе в кишечник pH среды повышается и ферри-ион необратимо выпадает в осадок в виде гидрооксида.
Описанные свойства ферри-иона сделали проблематичным использование солей трехвалентного железа в качестве перорального лекарственного средства. Для ферро-иона подобная реакция также имеет место, но ее влияние лишь незначительно снижает концентрацию введенных солей двухвалентного железа в кишечнике. В связи с этим современные пероральные препараты железа представлены двухвалентными соединениями, основным из которых является железа сульфат. Это обусловлено несколькими причинами:
- процент всасывания железа из сульфатных соединений наиболее высок (более 10 %) по сравнению с другими солями железа;
- сульфатные соединения обладают наименьшей токсичностью среди всех ионных соединений железа;
- при их использовании наблюдается наименьшее число побочных эффектов.
Хлорид закисного железа применялся только в жидкой лекарственной форме (препарат «Гемофер»), что объяснялось большей растворимостью хлорида железа в воде и возможностью снизить его концентрацию более чем в три раза (табл. 1) в растворе при введении равного количества элементарного железа по сравнению с сульфатными солями.
Вместе с тем, существуя в клетках в различных редокс-состояниях (Fe2+ и Fe3+), железо катализирует реакции, в которых ферро-ион окисляется до ферри-иона, являясь при этом восстановителем индуцирующим появление свободного электрона в результате чего генерируются свободные радикалы (рис. 3), нарушающие синтез ДНК, влияющие на активность ряда ферментов, вызывающих пероксидацию полиненасыщенных липидов клеточных мембран.
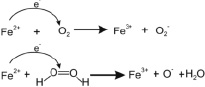
Рис. 3. Образование свободных радикалов ферро-ионами
Более того, созданные в кишечнике повышенные концентрации ферро-иона способствуют пассивному транспорту двухвалентного железа в энтероцит по градиенту концентрации, что приводит к попаданию токсичного ферро-иона в клетки слизистой оболочки кишечника и может служить причиной их гибели. Описанные свойства ферро-иона обуславливают его высокую токсичность. При этом наблюдается прямое цитотоксическое повреждающее воздействие железа на клетки различных органов, прежде всего мозга и печени [17]. Высокий риск возникновения побочных эффектов, интоксикации железом при терапии солевыми препаратами железа обусловлен механизмом всасывания двухвалентного железа путем пассивной диффузии.
В списке токсикантов в регистрах США, Канады и России соли двухвалентного железа фигурируют как самые опасные для детей, особенно первых двух лет жизни, в связи с показателями летальности, достигающим 50 % [34].
Таким образом, хотя заместительная терапия дефицита железа с помощью солевых препаратов железа является достаточно эффективной, высокий риск развития тяжелых побочных эффектов снижает их терапевтические возможности. Выход из ситуации был найден в снижении дозы солевых препаратов железа до 3 мг на 1 кг массы тела в сутки, что существенно уменьшает частоту побочных явлений.
Тем не менее, лечение пероральными препаратами железа, в частности сульфатом железа, вызывает побочные реакции у 44,7 % пациентов. Чаще всего страдает желудочно-кишечный тракт (ЖКТ). Симптомы дисфункции его верхних отделов обычно проявляются в течение часа после приема лекарства и могут протекать как в легкой (тошнота, дискомфорт в эпигастрии), так и в тяжелой форме – с болью в животе и/или рвотой. Кроме того, ферротерапия солевыми препаратами железа нередко сопровождается появлением металлического привкуса в течение первых дней лечения, потемнением зубной эмали и десен, возможны также диарея или запор. Хорошо известно, что солевые препараты железа в просвете кишечника взаимодействуют с компонентами пищи, лекарствами, затрудняя абсорбцию в том числе и железа. В связи с этим, их рекомендуют назначать за 1 час до приема пищи, однако это усиливает повреждающее действие соединений Fe2+ на слизистую кишечника, вплоть до развития ее некроза [11].
Расширение ассортимента железосодержащих лекарственных препаратов было направлено на решение двух главных проблем:
1. Защита ферро-иона от окисления, с целью сохранения его в растворимом виде и предотвращения пероксидации полиненасыщенных липидов клеточных мембран.
2. Снижение пассивного транспорта ферро-иона в энтероцит
В настоящее время на отечественном фармацевтическом рынке обращается несколько десятков железосодержаших препаратов [3, 26, 41], которые могут быть разделены на три большие группы (рис. 4):
а) препараты на основе неорганических солей железа
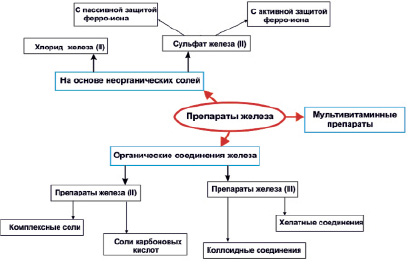
Рис. 4. Классификация препаратов железа
Препараты на основе только солей железа (такие как гемофер, конферон, гемоферпролангатум, ферро-градумет) весьма несовершенны. Замедление высвобождения ферро-иона из лекарственной формы путем заключения действующей субстанции в пористый наполнитель – градумет (гемоферпролангатум, ферро-градумет) лишь незначительно снижает частоту нежелательных лекарственных реакций. При использовании в качестве действующей субстанции ферро-ионов необходимо вводить одновременно протектор – защищающий от губительного действия двухвалентного железа. В данном случае наиболее универсальным защитным соединением является аскорбиновая кислота, т.к. образующиеся в результате окислительно-востановительнойреакции протоны, являясь акцепторами электронов, конкурентно подавляют образование пероксидных ионов и предохраняют ферро-ион от окисления в ферри-ион, тем самым сохраняя терапевтические концентрации двухвалентного железа в просвете кишечника. К препаратам данной подгруппы относятся: ферроплекс, сорбифер-дурулес, причем в последнем действующее вещество также заключено в пористый матрикс. Препарат сорбифер-дурулесявляется современным пролонгированным препаратом, содержащим 100 мг сульфата железа и 60мг аскорбиновой кислоты. Эти компоненты находятся в индифферентной пластиковой матрице губчатого строения. Освобождение железа происходит постепенно, сначала из поверхностных слоев системы, затем из более глубоких слоев. Благодаря этой технологии слизистая оболочка желудка раздражается в меньшей степени вследствие меньшей концентрации ионов железа при замедленном его освобождении. Освобождение железа происходит независимо от состояния среды желудка и кишечника. Таким образом, современный пероральный пролонгированный препарат железа сорбифер-дурулес, имеющий высокую концентрацию сульфата железа в сочетании с оптимальной дозой аскорбиновой кислоты, по фармакоэкономическому показателю «стоимость/эффективность» имеет неоспоримые преимущества перед другими препарата-ми железа и может быть препаратом выбора в лечении ЖДА [21].
Если использование аскорбиновой кислоты в качестве протектора можно отнести к активной защите ферро-иона, то применение аминокислот в качестве защиты (серин в актиферрине) или ферментов (мукопротеаза в тардиферроне) является элементом пассивной защиты. Суть такой защиты сводится, с одной стороны, к образованию хелатных соединений ферро-иона с аминокислотами, а с другой стороны в защите слизистой оболочки кишечника. Такие протекторы одновременно замедляют всасывание ферро-иона и снижают градиент концентрации, уменьшая тем самым пассивный транспорт ферро-ионов в энтероцит.
Следующим этапом совершенствования неорганических препаратов железа с протекторами ферро-иона стало повышение их эффективности путем стимуляции эритро- и гемопоэза. В частности, для нормального синтеза эритроцитов необходим ряд витаминов, оказывающих влияние на процесс кроветворения [5]:
- фолиевая кислота – участвует в синтезе ряда аминокислот (например, серина, глицина, гистидина, метионина) и, что особенно важно, метидина – компонента ДНК. Участие фолиевой кислоты в пуриновом обмене определяет значение ее для нормального роста, развития и пролиферации тканей, в частности для процессов кроветворения. Гематологическая патология в результате истощения ее запасов проявляется нарушением созревания, как эритроцитов, так и миелоидных клеток, что приводит к анемии и лейкопении;
- витамин B2 – необходим для образования липидной стромы;
- пантотеновая кислота – укрепляет липидную оболочку эритроцита повышая ее устойчивость к гемолизу;
- витамин B12 – стимулирует синтез глобина;
- витамин B6 – необходим для синтеза гема.
К данной подгруппе относятся такие препараты как: ферро-фольгамма, фесовит, фефол-вит, гино-тардиферон, актиферрин-композитум, иррадиан, фенюльс, в которых наряду с сульфатом железа и протекторами – аскорбиновой кислотой, серином, мукопротеазой, цистеином добавлены фолиевая кислота, витамины группы В и никотинамид в различных сочетаниях. К наиболее эффективным пофармакоэкономическим показателям препаратам данной группы можно отнести фенюльс, сочетающий терапевтическую дозу железа с витаминами группы В, никотинамидом и аскорбиновой кислотой. Причем действующая субстанция заключена в диализную оболочку гранулы, благодаря чему ферро-ионы постепенно и равномерно поступают в организм в течении 2 часов, что практически не вызывает побочных эффектов.
Несмотря на то, что заместительная терапия дефицита железа с помощью его солевых препаратов является достаточно эффективной, однако риск развития тяжелых побочных реакций все равно остается достаточно высоким, что снижает приверженность больных к лечению.
б) Препараты на основе органических соединений железа
В лекарственных средствах на основе органических соединений железа первоначально использовались соединения двухвалентного железа. Первыми нашли применения комплексные соединения, например, феррамид – в котором ион железа координационо соединен с двумя молекулами никотинамида. Последний обладает протекторными свойствами подобными аскорбиновой кислоте и обеспечивает не только защиту ферро-иона от окисления, но и замедляет его всасывании.
Препарат ферроцерон представляющий собой натриевую соль орто-карбоксибензоилферроцена относится к ароматическим структурам типа металлоцена, (дициклопентадиеновые соединения общей формулыС5Н5-Ме-С5Н5, имеющие структуру «сэндвича» в которых ферро-ион координационно связан с двумя лежащими в параллельных плоскостях циклопентодиеновымикольцами равноудален от всех атомов С. Сендвич-структура резко повышает устойчивость соединения в целом, а следовательно, в той или иной степени, защищает ферро-ион.
Большее применение нашли соли карбоновых кислот, т.к. было установлено, что протективными свойствами подобными свойствам аскорбиновой кислоты обладают и другие карбоновые кислоты: фумаровая (препараты ферронат и хеферол), молочная кислота (фитоферролактол), глюконовая кислота (тотема, феррлецит)
Для повышения эффективности в органические препараты железа вводили также стимуляторы эритропоэза фолиевую кислоту, витамин В12 (ранферон-12) и микроэлементы кроветворного комплекса Mn и Cu (тотема).
Проблема введения ферри-иона в организм была решена в группе препаратов органических соединений железа. Первоначально в составе хелатного соединения протеинсукцинилата железа (в препарате ферлатум), в котором протеин хелатировалферри-ион и способствовал его сохранению в растворе в просвете кишечника.
В последующем более продуктивном оказалось введение нерастворимого гидрооксида окисного железа в коллоидном растворе. В мицелле такого коллоидного раствора в качестве ядра мицеллы использовался нерастворимый Fe(OН)3, а плотный слой создавался углеводными соединениями, в качество которых выступали мальтоза (биофер, глобирон, мальтофер), сахароза (ферковен, венофер), сорбитол (эктофер, фербитол), изомальтоза (феррум лек).
Структура данного комплекса состоит из многоядерных центров гидроксида – Fe3+, окруженных нековалентно связанными молекулами моно- и дисахаров. Комплекс имеет большой молекулярный вес, что затрудняет его диффузию через мембрану слизистой кишечника. Химическая его структура максимально приближена к таковой естественных соединений железа с ферритином [49]. Абсорбция железа в виде гидроксид-полимальтозного комплекса (ГПК) имеет принципиально иную схему по сравнению с его ионными соединениями и осуществляется путем активного всасывания при конкурентном обмене лигандами, уровень которых определяет скорость абсорбции железа Fe3+. Неионная структура, обеспечивающая стабильность комплекса и перенос железа с помощью транспортного белка, предотвращает в организме свободную диффузию ионов железа, то есть прооксидантные реакции [49].
Следует заметить, что препараты с использованием сахарозы применяют в основном для внутривенного введения (венофер), в отличие от препаратов на основе изомеров мальтозы, которые применяют преимущественно перорально. Общеизвестно, что стереохимическая структура препарата имеет большое значение для его биологической активности, т.к. трехмерная ориентация атомов или функциональных групп важна для взаимодействия между фармаконом и рецептором. Оптимальная адаптация фармакона и рецептора может быть необходима для обеспечения селективного соединения или изменений в структуре рецептора. По этой причине стереоизомеры могут иметь абсолютно различные биологические активности.
Использование полимальтозата или полиизомальтозата оказывает влияние не только на физические свойства комплекса, такие как растворимость, но также на молекулярный вес и кинетику распада комплекса и, таким образом, также на эффективность препарата железа при лечении железодефицитной анемии.
Еще одно отличие между полиизомальтозой (декстран) и полимальтозой (декстрин) заключается в том, что декстран индуцирует анафилактические реакции (DIAR – декстран индуцируемые анафилактические реакции), которые вызываются при применении полиизомальтозата, но не полимальтозата [52].
В целом можно отметить, что органические соединения железа обладают меньшей токсичностью, причем наиболее безопасны полимальтозатные комплексы (табл. 2).
Таблица 2
Токсичность для различных препаратов железа [35]
|
Активное вещество препарата железа |
Острая токсичность (LD50) для различных препаратов железа, мг/кг |
|
Железа сульфат |
230 |
|
Железа фумарат |
320 |
|
Железа глюконат |
630 |
|
Гидрооксид-полимальтозатный комплекс железа ГПК-Fe3+ |
> 2000 |
Данные по безопасности, полученные во время клинических исследований препарата железа на основе гидроксида Fe3+ с полимальтозой (мальтофер), свидетельствуют о низкой частоте побочных реакций по сравнению с простыми солями железа [35, 46]. Только в некоторых случаях отмечается чувство переполнения желудка, тошнота, диарея или запор. В многочисленных сравнительных исследованиях было показано, что лечение препаратами на основе полимальтозатных комплексов Fe3+ переносилось значительно лучше (приверженность к лечению ими составляет 97,6-98 %), чем солевыми соединениями железа, что подтверждалось меньшей частотой нежелательных явлений, хотя значительной разницы в эффективности ферротерапии между группами выявлено не было.
Заместительная терапия дефицита железа с помощью Fe3+-ГПК также эффективна, как и при использовании сульфата железа. Побочные эффекты со стороны желудочно-кишечного тракта, а также частота прерывания лечения, наблюдаются значительно реже на фоне лечения ГПК-Fe3+.
в) Мультивитаминные препараты железа
В этой группе представлены мультивитаминные комплексы с минералами, в которых содержание железа в несколько раз меньше чем в лекарственных средствах других групп. В их составе железо находится в виде фумарата (витрум-циркус, витрум-суперстресс ,прегнавит, матерна, специальное драже Мерц), лактата (Доктор Тайсс-мультивитамол) или сульфата (витатресс), Содержание железа в мультивитаминных препаратах колеблется от 1,5 до 60 мг и препараты данной группы следует рассматривать скорее как профилактические средства, а не средства выбора фармакотерапии ЖДА.
Терапия ЖДА в основном проводится препаратами для внутреннего применения. Препараты железа для инъекций следует использовать по специальным показаниям: нарушения всасывания железа при заболеваниях желудочно-кишечного тракта, индивидуальная непереносимость солей железа, обострение язвенной болезни желудка и двенадцатиперстной кишки. Препараты железа для парентерального введения у 1-2 % больных дают аллергические реакции, вплоть до анафилактического шока, особенно при внутривенном введении. При внутримышечном введении этих препаратов у 0,5-6 % больных возникают инфильтраты в месте инъекций, абсцессы ягодичной области.
Таблица 3
Основные современные средства фармакотерапии ЖДА
|
Препарат, форма выпуска |
Состав |
Суточная доза препарата |
|
сорбиферДурулес таблетки |
сульфат железа 320 мг + + аскорбиновая кислота 60 мг |
2 таблетки |
|
актифферин капсулы |
сульфат железа 113,85 мг + L, D -серин 129 мг |
2-3 капсулы |
|
актифферинкомпозитум, капсулы |
сульфат железа 113,85 мг + L, D -серин 129 мг + фоливая кислота 500мкг + В12 300 мкг |
2-3 капсулы |
|
гемоферпролонгатум таблетки |
сульфат Fe 325 мг |
2-3 таблетки |
|
гино-тардиферон таблетки |
сульфат железа – 256 мг + фолиевая кислота 350 мг + аскорбиновая кислота 30 мг |
1-2 таблетки |
|
мальтофер, феррум лек таблетки |
Fe-ГПК 100 мг |
1-3 таблетки |
|
капли |
то же |
40-120 капель |
|
сироп |
то же |
10-30 мл |
|
мальтофер фол таблетки |
Fe-ГПК 100 мг + фолиевая кислотата 350 мкг |
1-3 таблетки |
|
тардиферон таблетки |
сульфат железа 256 мг |
1-2 таблетки |
|
тотема раствор для приема внутрь |
железа глюконат 5 мг/мл + марганца глюконат 133 мкг/мл + медиглюконат 70 мкг/мл |
20-40 мл |
|
фенюльс капсулы |
сульфат железа 150 мг + 10мг аскорбиновой кислоты + витамины В12 В2, В5, В6, PP |
1-2 капсулы |
|
ферроплекс драже |
сульфат железа – 50 мг; аскорбиновая кислота 30 мг |
8-9 драже |
|
ферро-градумет таблетки |
сульфат железа |
1-3 таблетки |
Таблица 4
Растения применяемые в фитотерапии заболеваний крови анемического характера
|
Растения, применяемые в научной медицине |
|
|
1 |
2 |
|
Британская травяная фармакопея [44] |
барвинок большой, гамамелис вирджинский, герань пятнистая, гидрастис канадский, горец змеиный, гречиха посевная, гравилат городской, дуб черешчатый, зюзник европейский, кник Бенедикта, календула лекарственная, крамерия трехтычинковая, крапива двудомная, кровохлебка лекарственная, лапчатка прямостоящая, люцерна посевная, манжетка обыкновенная, медуница лекарственная, окопник лекарственный, опунция виды, пастушья сумка обыкновенная, перец узколистный, подорожник большой, ракитник метельчатый, триллиум прямой, хвощ полевой, череда трехраздельная |
|
Фармакопеи восточноевропейских стран [25] |
барвинок малый, герань Роберта, горец змеиный, горец перечный, дуб черешчатый, крапива двудомная, кровохлебка лекарственная, лапчатка виды, маргаритка обыкновенная, одуванчик лекарственный, пастушья сумка обыкновенная подлесник европейский, синюха лазурная, тысячелистник обыкновенный, |
|
Госреестр РФ [9] |
горец перечный, калина обыкновенная, крапива двудомная, лабазник виды, лагохилус опьяняющий, омела белая, переступень белый, перец водяной, тысячелистник обыкновенный, хлопчатник виды, чистец буквицецветный, щавель конский |
|
Растения применяемые в народной медицине |
|
|
Западная Европа [4, 10] |
барвинок малый, вербенникмонетчатый, герань виды, горец птичий, гравилат виды, дербенник иволистный,, земляника лесная, золотарник обыкновенный, календула лекарственная, каштан съедобный, кипарис вечнозеленый, клевер луговой, крапива виды, крестовник Фукса, лапчатка прямостоящая, люцерна посевная, манжетка виды, миррис душистый, окопник лекарственный, пастушья сумка обыкновенная, перец водяной, подлесникевропейский, розмарин лекарственный, тысячелистник обыкновенный, фиалка трехцветная, фисташка мастичная, хурма японская, цикорий обыкновенный, черноголовник обыкновенный, яснотка белая. |
|
Восточная Европа [22, 24, 42, 43] |
абрикос обыкновенный, авокадо американское, аир болотный, айва продолговатая, акация белая, актинидия виды, алое древовидное, арбуз съедобный, арника горная, барвинок малый, брюква столовая, будра плющевидная, виноград культурный, вишня обыкновенная, голубика обыкновенная, горец птичий, горох посевной, гречиха посевная, девясил высокий, донник лекарственный, дыня посевная, ежевика сизая, жеруха водная, звездчатка средняя, зверобой продырявленный, земляника виды, золототысячник виды, инжир обыкновенный, иссоп обыкновенный, калужница болотная, кизил мужской, кипрей узколистный, клевер луговой, кник бенедиктинский, копытень европейский, костяника каменистая, крапива виды, крыжовник обыкновенный, крушина ольховидная, кувшинка белая, ламинария сахарная, левзеясафлоровидная, лещина обыкновенная, лимонник китайский, липа виды, манжетка виды, марь доброго Генриха, медуница лекарственная, медуница неясная, мелисса лекарственная, миндаль обыкновенный, морковь посевная, мята кошачья, настурция большая, облепиха крушиновидная, овес посевной, одуванчик лекарственный, окопник лекарственный, орех грецкий, очиток едкий, пажитник сенной, пикульник обыкновенный, пион тонколистый, полынь виды, пырей ползучий, редька черная, рябина обыкновенная, салат посевной, cвекла обыкновенная, сердечник горький, серпуха венценосная, синеголовник плосколистный, смородина виды, спаржа виды, тимьян виды, тыква обыкновенная, укроп душистый, унаби съедобный, фисташка настоящая, хвощ полевой, хрен обыкновенный, чай китайский, череда трехраздельная, шелковница черная, шиповник виды, шпинат огородный, щавель виды, яблоня виды, яснотка белая, ястребинка волосатая |
|
Растения применяемые в восточной медицине |
|
|
Индия [23] |
витания снотворная, горец многоцветковый, гранатовое дерево, коммифора мирра, куркума длинная, ремания клейкая, шафран посевной, эмблика лекарственная, якорцы стелющиеся |
|
Китай [37] |
астрагал хуанчи, атрактилис большеголовый, гирчевник китайский, дягиль лекарственный, коричник китайский, панакс женьшень, пион молочноцветковый, пориякокосовидная, ремания китайская, солодка голая, цитрус сетчатый |
|
Окончание табл. 4 |
|
|
1 |
2 |
|
Корея [40] |
биота восточная, блетилла гиацинтовая, гинура земляная, гинура женьшеневая, горец перечный, горец птичий, калина Саржента. крапива двудомная, кровохлебка лекарственная, лотос орехоносный, майник двулистный, пастушья сумка, полынь обыкновенная, ремания клейкая, рогоз восточный, сафлор красильный, соломоцвет японский, софора японская, спорынья, тысячелистник монгольский, цефалоноплос озимый, хвощ зимующий, хвощ полевой, хлопчатник, цезальпиния саппан, чистец байкальский |
|
Тибет [14, 31] |
акация катеху, акебия пятерная, арнебия бахромчатая, астрагал виды, башмачок капельнопятнистый, горец птичий, горох посевной,девясил высокий, карагана гривастая, ламиофломис колесовидный, лилия виды, макротомия красящая, облепиха крушиновидная, пикроризаноричниковоцветковая, полынь холодная, птерокарпус сандаловый, cафлор красильный, сверциячирата, соссюреяребристая,сумах китайский, фиалка двухцветковая, цезальпиния саппан, шалфей многоконевищный, эмблика лекарственная, юстиция Гендарусса |
В табл. 3 представлены основные характеристики современных пероральных синтетических лекарственных средств, наиболее часто применяемых в указанных схемах фармакотерапии ЖДА (табл. 4).
Несмотря на наличие в настоящее время современных синтетических лекарственных препаратов, таких как сорбифер-дурулес, мальтофер и фенюльс, проблема нежелательных лекарственных реакций, возникающих при их приеме, остается весьма актуальной.
Лекарственные растения в противоанемической терапии
Терапевтическая ценность лекарственных растений определяется входящими в их состав биологически активными соединениями. Биологически-активные соединения – индивидуальные химические соединения или их смеси в той или иной степени, влияющие на жизнедеятельность любых объектов живой природы, в т.ч. и на организм человека. Любое растительное сырье всегда содержит сложный набор соединений первичного и вторичного метаболизма, которые, определяют, так называемый «шрапнельный» эффект, т.е. эффект множественного воздействия на различные системы и органы организма. Более того, известен и закон множественности представителей отдельных групп веществ в растительном организме, согласно которому в каждом из классов синтезируемых соединений образуется ряд изоморфных гомологов [6], что еще более повышает поливалентность фармакологического действия каждого растения.
Специфичность действия фитопрепаратов обусловлена именно комплексом БАС, а не простой суммой индивидуальных химических соединений. Можно согласиться с утверждением [12], что «растительное лекарство – это цельный биогенетически сложившийся комплекс, включающий в себя активно действующие вещества и другие вторичные метаболиты, протеины, эфирные масла, хлорофилл, микроэлементы, неорганические соли, витамины и т.д.».
Лечебные свойства растений, эмпирически установленные в древние времена, находят научное обоснование в современной медицине. В Российской Федерации используется около 300 видов лекарственных растений [9]. В то же время в Государственную фармакопею Российской Федерации включено всего лишь 84 растения. Подобное соотношение свидетельствует о недостаточной изученности лекарственнoй флоры, что естественно сдерживает применение растений в клинической практике.
Поливалентность фармакологического действия растительных БАС и недостаточная изученность их фармакинетики не позволяют четко разделить лекарственные растения на фармакотерапевтические группы. В этой связи до настоящего времени нет единой общепринятой классификации лекарственного растительного сырья (ЛРС). Лекарственные растения используемые при лечении анемии (табл. 6) относят к группе гемостатиков – в государственном Реестре РФ выделена группа, включающая 12 растений обладающих гемостатическим действием [9]. В авторитетной Британской травяной фармакопее группа растений обладающих антигеморрагическим действием значительно шире и составляет 27 растений [44].
ЛРС обладающее противоанемическим действием выделено отдельно в известном руководстве С.Я. Соколова [36]. В нем в качестве дополнительных средств лечения анемий, независимо от патогенеза, рекомендуются препараты растительного происхождения, причем предпочтение отдается растениям, которые в значительном количестве содержат микроэлементы железа, меди (сушеница, лапчатка прямостоячая, марена красильная, подорожник, лен, шиповник, тимьян и др.), кобальта (кубышка, сушеница, черемуха, шиповник коричный и др.).
Больным анемией рекомендуется включать в рацион питания овощи и ягоды (черноплодная рябина, черная смородина, виноград, крыжовник, черника, черемуха, вишня и др.), содержащих значительное количество полифенольных соединений и аскорбиновой кислоты. Основу лечебных фитосборов могут также соствлять: аир, вахта, зверобой, мелисса, пустырник, ромашка, рябина обыкновенная, чистотел, земляника лесная, тысячелистник, шиповник, череда, золототысячник, калина, клевер, малина, одуванчик, черника, смородина черная, ежевика, овес, крапива. При нормальном уровне артериального давления используют растения-иммуномодуляторы и адаптогены: женьшень, заманиху, аралию, родиолу розовую (золотой корень), солодку и др.. Сами фитосборы составляют таким образом, чтобы воздействовать на желудочно-кишечный тракт (с целью улучшения его функционального состояния и повышения утилизации железа), на клеточный обмен (для усиления синтеза гемоглобина под действием витаминов и биологических стимуляторов), на осложнения при железодефицитной анемии, прежде всего обусловленные гипоксией тканей.
Значительно шире ассортимент лекарственных растений применяемых для терапии ЖДА в народной медицине Западной и Восточной Европы, Сибири и Дальнего Востока (табл. 4).
Поскольку географическое положение России характеризуется пересечением европейских и азиатских ареалов, представляют также интерес лекарственные растения, применяемые для терапии ЖДА в восточной медицине (табл. 4).
При всем своем многообразии все используемые растения с достаточной степенью условности, связанной с поливалентностью фармакологического действия, можно разделить на 6 групп (рис. 5).
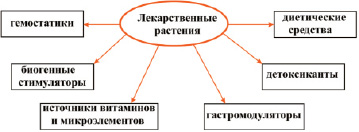
Рис. 5. Классификация лекарственных растений, применяемых в фитотерапии анемий
Данная классификация позволяет выделить этиотропную фитотерапию лекарственными растениями входящими в группы:
- гемостатиков – терапия направлена на уменьшение кровопотерь за счет внутренних кровотечений различного генеза;
- детоксикантов – терапия направлена на очищение крови от токсикантов, например, солей тяжелых металлов, свободных радикалов;
- гастромодуляторов – терапия направлена на восстановление функций желудочно-кишечного тракта и восстановление нормальной утилизации пищевого железа;
- биогенных стимуляторов – терапия направлена на восстановление нормального эритро- и гемопоэза, путем воздействия на органы кроветворения.
Патогенетическая фитотерапия ЖДА осуществляется за счет введения в организм дополнительного комплекса микроэлементов и витаминов из состава растений входящих в группы:
- источники витаминов и микроэлементов;
- диетические средства.
Наибольшее число растений относится к группе гемостатиков, кровоостанавливающее действие их обусловлено значительным содержанием дубильных веществ. Дубильные вещества вызывают коагуляцию белков плазмы крови и тромбируют поврежденные сосуды и капилляры, тормозя тем самым кровотечение [36]. К числу таких растений относятся горцы различных видов, дуб черешчатый, калина обыкновенная, чистец буквицецветный, кровохлебка лекарственная и ряд других. Алколоиды из состава гидрастиса канадского, спорыньи, гамамелиса вирджинского тормозят кровотечение за счет сосудосуживающего действия. Широко используемая как гемостатик крапива двудомная проявляет свои свойства за счет наличия в ее составе витамина К, стимулирующего выработку протромбина. Препараты лагохилуса опьяняющего активируют плазменные и клеточные факторы свертывания крови одновременно подавляя активность проактиваторовфибринолиза, т.е. помимо гемостатического действия проявляют и антифибринолитическую активность.
К группе детоксикантов можно отнести соломоцвет двузубый, горец птичий, мелиссу лекарственную, кукурузу, которые за счет увеличения диуреза способствуют выведению токсикантов.
Гастромодулирующие свойства проявляют аир болотный, вахта трехлистная, золототысячник обыкновенный, сверциячирата, полынь горькая, которые стимулируют и восстанавливают секрецию пищеварительных желез; проявляют обволакивающие или гастропротективные свойства – календула лекарственная, лабазник вязолистный, акация катеху. Действие гастрмодуляторов направлено на восстановление нормального уровня всасывания железа.
Свойства биогенных стимуляторов проявляют растения-адаптогены: родиола розовая, лимонник китайский, растения ведической медицины (см. табл. 5) и ряд других. Воздействуя на весь организм в целом фитопрепараты данных растений нормализуют работу всех желез внутренней секреции, восстанавливая нормальный уровень эритро- и гемопоэза.
Таблица 5
Содержание БАС и микроэлементов в растениях, применяемых в патогенетической фитотерапии ЖДА [2, 7, 29, 33]
|
Содержание веществ |
|||||||
|
Растение, сырье |
углеводы, % |
белки, % |
аскорбиновая кислота, мг % |
микроэлементы, мг % |
|||
|
Fe |
Mn |
Cu |
Co |
||||
|
Культурные растения |
|||||||
|
Абрикос плоды |
27 |
0,9 |
10 |
2,1 |
1,76 |
0,64 |
0,003 |
|
Виноград плоды |
17,5 |
0,5 |
6 |
0,6 |
0,09 |
0,08 |
0,002 |
|
Вишня плоды |
17,5 |
0,8 |
25 |
1,4 |
0,08 |
0,1 |
0,001 |
|
Яблоня плоды |
24 |
0,4 |
40 |
2,2 |
0,047 |
0,12 |
0,003 |
|
Дикорастущие растения |
|||||||
|
Арония плоды*1 |
11,5 |
- |
110 |
5 |
0,07 |
0,058 |
0,015 |
|
Актинидия плоды*1 |
13,6 |
- |
1200 |
4 |
2,2 |
1,2 |
0,001 |
|
- ‘‘ - листья*2 |
- |
- |
- |
30 |
10,4 |
1,3 |
- |
|
Голубика плоды*1 |
6,6 |
- |
25 |
0,8 |
3,0 |
3,0 |
0,029 |
|
- ‘‘ - листья*2 |
25 |
45 |
3,4 |
0,048 |
|||
|
Земляника плоды*1 |
15,0 |
1,8 |
35 |
1,2 |
0,2 |
0,13 |
0,004 |
|
- ‘‘ - листья*2 |
260 |
60 |
0,022 |
0,084 |
0,022 |
||
|
Смородина плоды*1 |
8,7 |
40 |
0,6 |
0,01 |
0,057 |
0,004 |
|
|
- ‘‘ - листья *2 |
250 |
20 |
0,023 |
0,017 |
0,022 |
||
|
Черника плоды*1 |
8,0 |
1,1 |
25 |
0,8 |
50 |
1,0 |
0,11 |
|
- ‘‘ - листья*2 |
- |
- |
- |
20 |
133,5 |
1,25 |
0,128 |
|
Овощные культуры |
|||||||
|
Свекла |
14,0 |
- |
10 |
1,4 |
0,66 |
0,14 |
0,002 |
|
Морковь |
9,2 |
1,3 |
25 |
0,7 |
0,2 |
0,08 |
0,002 |
|
Орехи |
|||||||
|
Орех грецкий |
10,2 |
21 |
300 |
2,3 |
1,9 |
0,53 |
0,007 |
|
Растения, источники витаминов и микроэлементов |
|||||||
|
Крапива двудомная, трава*3 |
- |
- |
350 |
30 |
45 |
6,4 |
0,05 |
|
Череда трехраздельная, трава |
- |
- |
65 |
20 |
21 |
0,45 |
0,065 |
|
Шиповник коричный, плоды*3 |
- |
- |
1200 |
11,5 |
55 |
0,38 |
0,058 |
|
Кубышка желтая*3 |
- |
- |
- |
140 |
13,1 |
3,33 |
0,44 |
|
Лапчатка прямостоящая, трава*3 |
- |
- |
240 |
40 |
0,25 |
0,104 |
0,096 |
|
Медуница лекарственная трава*3 |
- |
- |
30 |
20 |
150 |
0,41 |
0,37 |
|
Среднее содержание |
|||||||
|
*1 – в плодах |
- |
- |
47 |
2,0 |
9,2 |
1,1 |
0,027 |
|
*2 – в листях |
- |
- |
255 |
31 |
38 |
1,2 |
0,055 |
|
*3 – в выбранной группе |
- |
- |
315 |
44 |
47 |
1,85 |
0,18 |
|
В растениях в целом |
- |
- |
- |
20 |
1 |
0,2 |
0,002 |
В восточной медицине в основном для лечения анемии используют именно биогенные стимуляторы, что объясняется принципиально иным терапевтическим подходом к лечению болезни. Исходя из ведущего принципа о единой целостности человеческого организма, восточная медицина рассматривает любое заболевание как болезнь всего организма, и лечению подвергается не болезнь, а больной человек, и принцип лекарственной терапии слагается из трех моментов:
1) назначается лекарственный препарат, тонизирующий и нормализующий деятельность желудочно-кишечного тракта, с целью улучшения усвояемости лекарственных препаратов;
2) в зависимости от выявленных при обследовании больного расстройств функций органов и систем, применяются средства тонизирующие, а также стимулирующие и нормализующие работу определенных органов и систем. Эти средства повышают защитные функции организма, устраняют причины, из-за которых развилось данное заболевание;
3) назначаются лекарственные препараты, специфические для данного заболевания. В индо-тибетской медицине некоторые симптомы болезни рассматриваются как проявление защитных сил организма, и поэтому чисто патогенетические средства применяются с осторожностью. Особенно отчетливо это прослеживается в ведических средствах, в то время как в корейской, тибетской и китайской медицинах применяются отдельные растения из группы гемостатиков.
Лекарственные растения с преобладающим патогенетическим механизмом действия разделены на две группы – диетики и источники витаминов и микроэлементов. В табл. 6 приведены сравнительные данные по содержанию некоторых БАС и микроэлементов кроветворного комплекса в различных морфологических частях растений, являющихся концентраторами микроэлементов. Анализ приведенных данных показывает, что в плодах содержание микроэлементов минимально, а содержание железа на порядок меньше среднего значения для растений в целом. При сравнении данных о содержании БАС в плодах и листьях одного и того же растения можно заметить, что содержание аскорбиновой кислоты в плодах в 5 раз (за исключением плодов актинидии), железа в 15 раз, кобальта в 2 раза ниже, чем в листьях при сравнительно равном содержании меди. В плодах значительно больше углеводов и белков, что повышает их энергетическую ценность как продуктов питания, чего нельзя сказать об их фармакологической ценности, как источниках микроэлементов. Аналогичные соотношения наблюдаются для овощей и орехов, с единственным отличием, связанным со большим содержанием белка и аскорбиновой кислоты в орехах. В то же время если зрелые ядра ореха содержат 300 мг % аскорбиновой кислоты, то ее содержание в зеленом околоплоднике и в недозрелых орехах доходит до 2500 мг %.
В соответствии с закономерностями протекания физиологических процессов в растительном организме созревание сочных плодов характеризуется снижением соотношения кислот и сахаров в пользу последних, образованием ароматических веществ, разложением хлорофилла и дубильных веществ, накоплением антоцианов и других вакуолярных пигментов, уменьшением твердости и упругости тканей благодаря гидролизу пектиновых веществ клеточных стенок [27]. На основании анализа приведенных данных можно сделать вывод о более эффективном использовании в патогенетической терапии ЖДА лекарственных растений-источников витаминов и микроэлементов по сравнению с диетическими средствами (плодами, орехами, овощами).
Микроэлементы кроветворного комплекса, необходимые для нормального гемопоэза в организме человека являются и жизненно необходимыми для функционирования растительного организма. В составе соединений, содержащих гем (все цитохромы, каталаза, пероксидаза), и в негемовой форме (железосерные центры) железо принимает участие в функционировании основных редокс-систем фотосинтеза и дыхания растения. Железо катализирует также начальные этапы синтеза хлорофилла (образование -аминолевулиновой кислоты и протопорфиринов). Образующиеся в животном или растительном организме две молекулы -аминолевулиновой кислоты циклизуясь формируют пиррольное соединение – порфобилиноген. Конденсируясь четыре молекулы порфибилиногена образуют уропорфириноген, который после декарбоксилирования переходит в протопорфирин. Дальнейший путь развития протопорфирина зависит от вида металла: с участием железа образуется гем и в последующем гемоглобин, с участием магния образуется протохлорофиллид и затем хлорофилл.
В растениях железо включается запасной белок ферритин, структура которого идентична структуре ферритина организма человека. В больших количествах ферритин присутствует в пластидах, которые содержатся в зеленых вегетативных органах растения, марганец также накапливается в листьях. Такой характер распределения микроэлементов в растениях и объясняет различия в их содержании в плодах и листьях. Железо, в составе комплекса БАС из зеленых органов растений, находится в форме ферритина и в этом смысле должно превосходить в биодоступности синтетический аналог ферритина – полимальтозатный комплекс железа (мальтофер). Важно также отметить, что железо катализирует начальные этапы синтеза -аминолевулиновой кислоты и, возможно, способно проявлять в организме человека гемопэтические свойства.
В связи с тем, что индивидуальные растения редко содержат одновременно максимальные количества витаминов, микроэлементов, полифенольных веществ, современная фитотерапия ЖДА базируется на применении фитосборов, позволяющих создавать композиции с максимальным содержанием необходимых БАС. В табл. 6 приведены состав, дозировка и способ приготовления ряда фитосборов, применяемых в научной и народной медицине для лечения ЖДА. В составе указанных сборов используются растения разных групп – гемостатики – крапива двудомная, калина обыкновенная, гастромодуляторы – аир болотный, дягиль обыкновенный, мята перечная,полынь обыкновенная; детоксиканты – береза повислая, хвощ полевой. Высокое содержание аскорбиновой кислоты в сборах обеспечивается использованием плодов шиповника, ореха грецкого, оптимальный микроэлементный состав обеспечивается применением земляники лесной, смородины черной, медуницы темной, череды трехраздельной, черники обыкновенной.
Таблица 6
Фитосборы для лечения ЖДА
|
№ п/п |
Состав сбора |
лекарственная форма |
ссылка |
|
1 |
листья березы повислой, трава будры плющевидной, земляники лесной,крапивы двудомной, репейничка обыкновенного, ветки омелы белой |
настой 6,0:400,0 |
[30] |
|
2 |
листья березы бородавчатой, ежевики сизой, крапивы двудомной, одуванчик лекарственный (все растение), трава тысячелистника обыкновенного, чистотела большого |
настой 6,0:400,0 |
|
|
3 |
листья березы повислой, ежевики сизой лист, крапивы двудомной, смородины черной, трава медуницы темной, пырея ползучего, стебли овса посевного |
настой 15,0:600,0 |
|
|
4 |
листья березы повислой, крапивы двудомной, трава земляники лесной, ветки с листьями смородины черной, плоды шиповника коричного |
настой 6,0:400,0 |
|
|
5 |
корневище аира обыкновенного, корни одуванчика лекарственного, листья крапивы двудомной, эвкалипта прутовидного, трава дымянки аптечной, полыни горькой, хвоща полевого |
настой 5,0:200,0 |
[8] |
|
6 |
листья березы повислой, мяты перечной, ореха грецкого, трава зверобоя продырявленного, татарника колючего, цикория обыкновенного, яснотки белой, плоды можжевельника |
настой 5,0:200,0 |
|
|
7 |
трава зверобоя, яснотки, тысячелистника, листья земляники лесной, солома овса, корневище солодки, побеги черники |
настой 6,0:250,0 |
[38] |
|
8 |
трава зверобоя, первоцвета и яснотки, череды, плоды шиповника, корневище дягиля и аира, цветки гречихи и калины, побеги облепихи, листья ореха грецкого |
настой 8,0:400,0 |
|
|
9 |
листья ежевики, смородины черной, трава череды, полыни обыкновенной, цветки калины, плоды шиповника, цетрария |
настой 6,0:250,0 |
|
|
10 |
листья подорожника большого, трава синюхи голубой, сушеницы топяной, шалфея лекарственного,тимьяна ползучего, лапчатки прямостоячей, плоды шиповника коричного |
настой 10,0:200,0 |
[36] |
|
11 |
трава череды трехраздельной, крапивы двудомной, лесной земляники, плоды шиповника |
настой 5,0:200,0 |
[39] |
К числу биогенных стимуляторов можно отнести солодку голую за счет кортикостероидоподобного действия глицирризиновой кислоты, эвкалипт прутовидный за счет регенераторной активности хлорофилла.
Нашими исследования [19, 47, 48] было показано, что для отнесения лекарственного растения к источникам микроэлементов кроветворного комплекса важно не содержание этих элементов в нативном растении, а их соотношение в получаемых фитопрепаратов. Только в водных экстрактах полученных из медуницы мягкой и фитосбора № 11 (табл. 6) содержание марганца и железа эквимолярно. В этом случае [19] соотношение редокс-потенциалов пары Fe/Mn таково, что в полученном извлечении железо находится в трехвалентном состоянии. В случае медуницы трехвалентное железо не выпадает в осадок из-за хелатирующего действия нативного белково-полисахаридного комплекса [20] в составе растения. В случае сбора № 11 таким агентом могут быть полисахариды череды, тем более что аскорбиновая кислота из плодов шиповника создаст кислую среду.
Следует также заметить, что все лекарственные растения (и индивидуально и в составе фитосборов) применяются в виде водных настоев, а суточная терапевтическая доза колеблется в пределах 5-15 г в пересчете на воздушно-сухое сырье. В такой терапевтической дозе может содержатся от 2,5 до 10 мг железа, в то время как содержание элементарного железа в средней дозе синтетического препарата ~ 100 мг. Вероятнее всего действие фитопрепарата комплексно и проявляется не только во введении дополнительного источника железа, но железа «ферментативно-активного», способного катализировать начальные этапы синтеза гемоглобина, увеличивая тем самым гемопоэз, а с другой стороны повысить утилизацию в организме железа поступающего с пищей.
 science-review.ru
science-review.ru