В настоящее время тяжёлые травмы, которые нередко приводят к развитию травматического шока, занимают третье место в ряду причин общей смертности населения, а в группе лиц моложе 45 лет стойко удерживают первое место [1, 20].
Одним из самых сложных вопросов проблемы шока – вопрос его патогенеза. Многие авторы предпочитают всю сущность шока объяснить нарушениями гемодинамики. Нормальная гемодинамика зависит от объема циркулирующей крови (ОЦК), объема сосудистого русла или тонуса сосудов и контрактильных свойств миокарда; недостаточность любого из этих компонентов ведет к недостаточности кровообращения [11]. Общеизвестен факт уменьшения ОЦК при травматическом и других формах шока [13,14, 17], но разные авторы по разному объясняют причины его возникновения. Уменьшение ОЦК при травматическом шоке связывается с перемещением внутрисосудистой жидкости в ткани, депонированием крови и в меньшей степени крово- и плазмопотерей в травмированных тканях [6]. По современным представлениям ведущая роль в патогенезе травматического шока принадлежит крово-плазмопотере , однако, не совсем ясна роль кровопотери в развитии травматического шока [18]. Для клиники наиболее характерными являются случаи травматического шока с острой кровопотерей; да и многие современные авторы травматический шок относят к категории гиповолемического (геморрагического ) шока или шока с дефицитом ОЦК [14]. В условиях шокового кровообращения, при уменьшении ОЦК, та или иная кровопотеря имеет огромное значение: она утяжеляет шоковый процесс [18] , тем более, что при шоке по методике В. Кеннона в травмированных тканях и так теряется постепенно до 2-х, а в некоторых опытах - до 3% жидкости от веса тела. Естественно, что это не только кровь, но и отечная жидкость, так что крово- и плазмопотеря наблюдается при любой механической травме [9,18, 21].
Еще не разрешен вопрос о характере и месте депонирования крови при шоке. Депонирования крови – перераспределение ее между различными участками сосудистого русла и избирательную концентрацию ее в каких-либо органах и тканях при шоке - отрицают многие авторы [3]; другие исследователи шока высказывают сомнение в отношении возможности депонирования крови [10]. Вопреки этому, многие авторы отмечают при травматическом и других формах шока депонирование крови в печени и селезенке [7,8].
На основании обширной литературы некоторые авторы высказывают мнение, что доказательства, приводящие к подтверждению депонирования крови, носят большей частью косвенный характер [2]; отмечается, что распространенный парез мелких ветвей печеночной и воротной вен, резко выраженное расширение и переполнение кровью синусоидов, агрегация форменных элементов, стазы в печени указывают на замедление скорости кровотока и отражают процесс патологического депонирования [12].
Исходя из вышесказанного очевидно, что и по сегодняшний день дискуссионным являются многие вопросы патогенеза шока; углубленное изучение патоморфологии шока необходимо прежде всего для понимания сущности тех нарушении, которые развиваются в «шок органах »; общеизвестно, что к ним относят и печень .
Цель исследования
Целью настоящего исследования явилось сравнительное изучение структурных изменений в сосудистом русле печени с помощью гистологических и морфометрических методов исследования в терминальной стадии экспериментального травматического шока в комбинации с острой кровопотерей и без нее, а также, провести морфологический анализ полученных результатов.
Материал и методы исследования
Эксперименты проведены на 22 беспородных половозрелых ненаркотизированных собаках обоего пола. Шок вызывали по методу W.Cannon [15]. В первой серии опытов (8 собак) по мягким тканям бедра собаки наносились удары в количестве, необходимом для стойкого снижения системного артериального давления до уровня 40-50 мм рт. ст. Во второй серии опытов (8 собак) по мягким тканям бедра собаки наносились удары до тех пор, пока системное артериальное давление не снижалось до уровня 80-90 мм рт. ст.; непосредственно вслед за этим дополнительно вызывалось кровотечение из бедренной артерии, снижающее артериальное давление до уровня 40-50 мм рт. ст. При нанесении механической травмы молотком удары, в пределах возможности, строго дозировались по частоте, силе и количеству. Все экспериментальные животные перед нанесением травмы, а также контрольные собаки (6 собак), перед взятием исследуемого материала, фиксировались на операционном столе в положении на спине. Под местной анестезией 0,5% раствором новокаина выделялась правая сонная артерия, затем она канюлировалась и соединялась с U – образным ртутным манометром Людовика для записи артериального давления; канюлировались также левые бедренные артерия и вена. Печеночная ткань бралась при снижении системного артериального давления до 25-30 мм рт. ст. путем операционной биопсии. Продолжительность шока до установления данного уровня артериального давления в первой серии опытов составляла от 38 минут до 1-го часа 3 минут, а во второй серии опытов - от 50 минут до 1-го часа 20 минут. Кусочки печени фиксировались в жидкости Карнуа. Парафиновые срезы толщиной до 5 мк окрашивались гематоксилин-эозином и пикрофуксином по методу ван Гизона. Кусочки печени, фиксированные в 12% растворе формалина, заливались парафином и использовались для окрашивания эластических волокон методом Вейгерта. Для морфометрической оценки печени применялась окулярная вставка «ВК-4». Методом точечного счета измерялись средние доли гепатоцитов и синусоидов и их доверительные интервалы в процентах. На срезах печени, окрашенных гематоксилин-эозином, при увеличении 20x10, подсчитивались точки вставки «ВК-4», попадающие на изображение гепатоцитов, синусоидов и остальных элементов. При статистическом анализе использовали компьютерный пакет программ «Биостатистика». Исследование проводилось согласно локальным правилам по содержанию и использованию лабораторных животных.
Результаты исследования и их обсуждение
На фоне нормальной микроструктуры печеночной ткани местами встречаются признаки расстройства внутриорганной гемодинамики, которые носят очаговый характер и достигают разной степени.
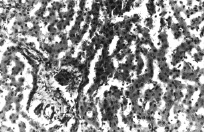
Рис. 1. Печень собаки из I серии экспериментов
Нарушение балочного строения печени, расширение синусоидов, нарушение целостности портальных сосудов, мелкие очажки кровоизлияний, гепатоциты в стадии зернистой дистрофии.Парафиновые срезы, окраска гематоксилин-эозином, увеличение: ×400.
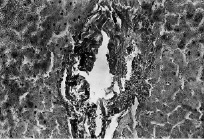
Рис. 2. Печень собаки из I серии экспериментов
Вокруг портального поля коллагеновые волокна грубые, разрыхленные, отечные; агрегация эритроцитов в сосудах, скопление мелких зерен гемосидерина. Парафиновые срезы, окраска пикрофуксином по ван Гизону, увеличение: ×400.
В первой серии опытов наблюдается расширение как междольковых портальных вен, так и синусоидных кровеносных капилляров и центральных вен, неравноменрное кровенаполнение печени; местами кровеносные сосуды, особенно венозные, переполнены форменными элеиентами крови. Эндотелиальные клетки часто выбухают в просвет синусоидов. Расширенные синусоидные кровеносные капилляры особенно часто отмечаются в области портальных полей, под капсулой; в этих участках встречаются также очажки кровоизлияний (рис. 1). Артериальные сосуды часто были свободны от форменных элементов крови. Они сохраняют свои средние размеры. Вокруг портального поля коллагеновые волокна грубые, разрыхленные, отечные; отмечается агрегация эритроцитов в сосудах, скопление мелких зерен гемосидерина (рис. 2).
Во второй серии опытов изменения гистоструктуры печени выражены ярче. В первую очередь внимание обращает преймущественный отек и неравномерное кровенаполнение как синусоидов, так и кровеносных сосудов (центральная вена, портальные вены); большинство синусоидов переполнено кровью. Местами в просветах сосудов, особенно в просветах венулярного звена, обнаруживается склеивание эритроцитов в агрегаты. В некоторых случаях целостность как синусоидов, так и крупных сосудов нарушена, сохраненные синусоиды кровенаполнены; почти во всех участках печеночной паренхимы наблюдаются кровоизлияния, местами обширные, а также скопление липофусцина (рис. 3).
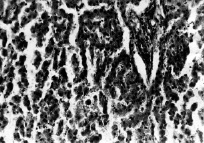
Рис. 3. Печень собаки из II серии экспериментов
Нарушение балочного строения печени; обширные кровоизлияния; некрозы гепатоцитов. Парафиновые срезы, окраска гематоксилин-эозином, увеличение: ×400.
В первой, а также во второй, сериях опытов по сравнению с контролем статистически достоверно уменьшилось средняя доля гепатоцитов и возросло средняя доля синусоидов (рис. 4); по этим параметрам нет статистически достоверной разницы между I и II сериями опытов.
Выявленное статистически достоверное возрастангие средней доли синусоидов подтверждает факт увеличения их диаметра; в отличие от тех авторов, которые считают патогномичным для «шоковой печени» расширение центральных синусоидов [16, 19], мы наблюдали расширенные синусоиды преимущественно в области портальных полей, под капсулой. Это отмечено и другими авторами [ 4, 11].

Рис. 4. Средние доли гепатоцитов (А) (%) и синусоидов (Б) (%) в контроле, в первой (1) и во второй (2)сериях экспериментов
В наших экспериментах в печени мы наблюдали кровенаполнение преимущественно венозных сосудов; как отмечают некоторые авторы, накопление венозной крови в периферических сосудах органов и тканей как бы защищает их от полного обескровливания и последующего некробиоза [5].
Мы согласны с теми авторами, которые считают, что факты, приводимые в подтверждение депонирования крови, носят в основном косвенный характер [2]. Если мы, например, согласимся с тем, что резко выраженное расширение и переполнение кровью синусоидов, агрегация форменных элементов кровы, стазы в печени отражают процесс патологического депонирования [12], то можно предположить, что в наших экспериментах имеет место патологическое депонирование крови. По нашему мнению, объем проведенных нами исследований не является достаточным для того, чтобы сделать какие-либо выводы относительно этого вопроса, но мы склонны согласиться скорее с теми авторами, которые высказывают сомнение насчет депонирования крови при шоке или вообще отрицают его [3, 10].
Заключение
Очевидно, что в сосудистом русле печени в терминальной стадии экспериментального травматического шока в комбинации с острой кровопотерей и без нее развываются однотипные неспецифические изменения, что способствует возникновению очагов дистрофии и некроза в этом органе. При этом , более глубокие изменения наблюдаются при травматическом шоке, комбинированном с острой кровопотерей : обширные кровоизлияния, некрозы гепатоцитов (рис. 3), что можно связывать с современным предположением о ведущей роли крово-плазмопотери в патогенезе травматического шока [18].
 science-review.ru
science-review.ru