Фибрилляция предсердий (ФП) является одним из наиболее часто встречающихся типов наджелудочковой тахиаритмии, с которой приходится сталкиваться врачу-кардиохирургу в повседневной клинической практике. Для данного вида аритмии характерна некоординированная электрическая активность предсердий со снижением их сократительной функции, что приводит к нерегулярному ритму желудочков сердца. Проведенные статистические исследования показали, что распространенность ФП составляет около 1 % среди лиц моложе 55 лет, тогда как среди пациентов старше 80 лет данная патология встречается у 10 % лиц [1]. К основным факторам риска развития и возможных осложнений ФП относятся такие состояния, как синдром ночного апноэ, субклинический гипертиреоз и хронические обструктивные заболевания легких [2].
Согласно современной концепции данный вид аритмии развивается поэтапно: сначала возникает первичный пароксизм, затем повторные с возможным переходом в персистирующую форму, а при неэффективности лечения и возникновении частых рецидивов происходит трансформация в постоянную форму. В соответствии с этим на практике выделяют несколько различных видов ФП: пароксизмальную (характеризуется самопроизвольным прекращением эпизодов, либо приступы купируются кардиоверсией в срок до 7 дней), персистирующую (эпизоды сохраняются дольше 7 дней), длительно-персистирующую, когда аритмия продолжается более 1 года, а также постоянную форму, при которой прекращаются попытки восстановления синусового ритма. Пароксизмальная форма является аритмией очагового типа, индуцируемой электрическим возбуждением, возникающим чаще всего в легочных венах, реже в верхней полой вене, вене Маршалла или коронарном синусе. При персистирующей или длительно-персистирующей формах ФП зачастую у пациента наблюдаются органические заболевания сердца. В данных случаях аритмогенная активность связана как со структурными изменениями (фиброз), так и с электрическим ремоделированием стенок предсердий [3]. Наличие частых рецидивов при ФП приводит к увеличению риска тромбоэмболических осложнений, что приводит к уменьшению толерантности к физическим нагрузкам и снижению качества жизни больных.
Механизмы возникновения различных видов кардиоаритмий изучаются на протяжении нескольких десятилетий, однако единого представления об электрофизиологической этиологии ФП не сформировано, а предложенные концепции хирургического и интервенционного лечения требуют дальнейшей проработки [4]. Внедрение современных систем навигационного электроанатомического картирования привело к возможности и появлению средств проведения антральной изоляция легочных вен (ЛВ) с помощью построения изопотенциальных карт возбуждения миокарда и выполнения дополнительных линий воздействия. Основным методом интервенционного лечения ФП является малоинвазивное высокочастотное токовое воздействие (абляция) на критические точки возникновения аритмии. Радиочастотная абляция является достаточно сложной процедурой с манипулятивной точки зрения, связанной с огромным числом областей воздействия, локализованных в антральных областях левого и правого предсердий. Данная операция является крайне продолжительной (длительность операции варьируется от 1,5 до 4 ч), и чаще всего ее проводят с помощью катетерных технологий. Широкое распространение этой методики связано в первую очередь с хорошими результатами при минимальной инвазивности. По некоторым данным катетерная абляция эффективна более чем у 70 % пациентов с пароксизмальной формой ФП, однако ее эффективность снижается для больных с персистирующей и постоянной формами аритмии. Подобные результаты можно объяснить ремоделированием стенок предсердий и появлением новых источников ФП при её длительном течении, а также ограничениями выбранной стратегии абляции [5]. Таким образом, понимание и исследование механизмов возникновения изменений внутрипредсердной проводимости играет ключевую роль при выборе методики эффективного лечения фибрилляции предсердий.
Цель исследования: разработка метода обработки и анализа комплексных фракционных эндокардиограмм для оценки нарушений проводимости электроанатомических участков левого предсердия и выявления очагов патофизиологической активности сердца.
Материалы и методы исследования
При экспериментальном изучении моделей существования ФП было показано, что источник нарушения внутрипредсердной проводимости электрического возбуждения почти полностью определяет генез и характер аритмии. Обычно выделяют два механизма развития ФП: очаговую активность и формирование множественных «блуждающих» коротких цепей риентри. Для возникновения аритмии необходимо наличие электроанатомического субстрата или характерного триггера, а также фактора, поддерживающего ее. Триггеры могут быть расположены в пограничном гребне, устье коронарного синуса, межпредсердной перегородке, свободной стенке предсердий, однако наиболее частая их локализация – легочные вены, ткань которых характеризуется коротким рефрактерным периодом проводимости. Множественные волны электрического возбуждения предсердий, взаимодействующие между собой, приводят к формированию вторичных волн, которые способствуют поддержанию аритмии. После формирования повторных пароксизмов происходит электрофизиологическое ремоделирование предсердий, при котором снижаются продолжительность потенциала действия и рефрактерный период [6]. К основным причинам подобных изменений относятся дисфункция вегетативной нервной системы, а также влияние тахиаритмии на функцию проводящих путей сердечной ткани.
Развитию пароксизмов сокращений предсердий способствуют также некоторые анатомические особенности, например, нечетко отделенные границы гладкой и трабекулярной частей предсердий, фиброзные кольца митрального и трехстворчатого клапанов, а также множество отверстий – устья полых и легочных вен или коронарного синуса. Наличие подобных областей вместе с другими факторами приводят к изменению свойств распространения электрического импульса возбуждения, которые наблюдаются даже при отсутствии изменений проводящей системы предсердий. Из-за различий клеточной электрофизиологии между смежными анатомическими областями возникает неоднородность восстановления возбудимости предсердий в целом. В исследовании Allessie показано, что рефрактерный период левого предсердия существенно отличается от правого, что частично объясняет его способность поддерживать фибрилляторную активность желудочков за счет возникающих множественных волн микрореентри, а правого – за счет трепетаний с формированием одиночного круга риентри [7].
Снижение длины волны рефрактерности приводит к тому, что электрический импульс возбуждения возвращается в начальную точку в момент, когда эндокардиальная ткань еще находится в рефрактерном периоде, что приводит к формированию множественных вторичных волн риентри и повышает риск возникновения ФП. Первичный электрический импульс возбуждения, отвечающий за формирование риентри, блокируется в волокнах с длинным рефрактерным периодом и распространяется по участкам возбудимой ткани со сниженной рефрактерностью, возвращаясь к начальным волокнам в момент восстановления возбудимости. Если период рефрактерности оказывается сниженным и межклеточная передача потенциала действия между эндокардиальными областями предсердия осуществляется медленно, то вероятность возникновения циркулирующих импульсов после отдельного одиночного круга риентри существенно повышается. Согласно теории спиральных волн или роторов, формируемая волна риентри имеет сходство со спиралью, которая быстро вращается вокруг центрального ядра [8]. Продолжительность данного процесса зависит от параметров клеточной возбудимости и предсердной рефрактерности, а направление вращения по предсердиям меняется с медленной скоростью, нарушающей их электрическую стабильность. Для эффективного «симптоматического» лечения ФП необходимо увеличить длину волны за счет повышения рефрактерного периода, что осуществляется с помощью антиаритмических препаратов, либо прервать путь прохождения импульса с помощью радиочастотного воздействия на патофизиологические участки миокарда.
Длительное существование аритмии является результатом электрофизиологического и структурного ремоделирования предсердий, а также влиянием патофизиологических изменений. Подобные изменения способствуют фрагментации распространяющегося фронта волны возбуждения и разделения на вторичные волны, каждая из которых становится независимой и ускоряет или замедляет свое движение до момента встречи с невозбудимой тканью. Дочерние волны могут взаимодействовать с соседними волнами, изменяться по направлению распространения, что во многом определяет хаотичный характер возбудимости окружающей эндокардиальной ткани.
На текущий момент существует несколько методик локализации роторов возбуждения ФП [9]. Среди них широкое применение получили биполярное и униполярное картирование при помощи контактных электродов с регистрацией комплексных фракционных эндокардиограмм (КФЭГ). Выделенные участки пространственно-временного распределения комплексной электрической активности являются наиболее аритмогенными и приоритетными для воздействия с помощью катетерной абляции. Спектральный анализ записанных эндокардиограмм (рис. 1) позволяет выявить стабильные очаги микрореентри и степень нестабильности процессов электрофизиологического возбуждения. В ряде случаев, при которых анализ временных параметров ЭГ затруднен, степень электрофизиологической активности предсердий можно оценить с помощью анализа доминантной частоты [10]. Тем не менее клиническая ценность и эффективность методики спектрального картирования остается неопределенной. Кроме того, использование стандартных электроанатомических систем картирования при малом размере зоны ритмогенеза не позволяет отличить источник фокусного возбуждения от ротора, так как компактный ротор имитирует эктопический очаг возбуждения.
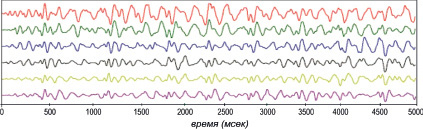
Рис. 1. Фрагменты записанных эндокардиограмм после цифровой фильтрации
Результаты исследования и их обсуждение
С целью изучения электрофизиологических свойств внутрипредсердной активности при персистирующей форме ФП была сформирована клиническая группа из 23 пациентов, проходивших лечение в отделении интервенционной кардиологии ФГКУ «Главный военный клинический госпиталь имени академика Н.Н. Бурденко» Министерства обороны РФ (средний возраст 51,6 ± 3,6 лет). Процедура электроанатомического картирования предсердий проводилась для каждого пациента группы с использованием нефлюороскопической системы трехмерной навигации Carto3 (Biosense Webster, США). Под местной анестезией раствором новокаина (0,5 %) выполнялось пунктирование левой подключичной вены для введения референтного электрода и правой бедренной вены для картирующего/аблационного электрода. В качестве диагностического референтного электрода использовали 10-полюсный электрод Webster (6F), который проводился во всех случаях в коронарный синус и служил для регистрации эндокардиограмм, диагностической стимуляции и в качестве анатомического ориентира. Для картирования использовался биполярный катетер NaviStar ThermoCool (Biosense Webster, США) с диаметром 3,5 мм между электродами, который вводился в ЛП через бедренную вену.
Во время исследований картирующий электрод продвигали, описывая эллипсоидную траекторию по поверхности камеры с фиксацией анатомических точек электрофизиологической карты. После построения трехмерной карты сердца осуществлялась последовательная запись внутрипредсердных эндокардиограмм длительностью 10 с в основных анатомических областей предсердия. Для предварительной фильтрации сигналов применялся полосно-пропускающий фильтр Баттерворта высокого порядка с частотами среза, равными 3 и 60 Гц. Выбор данной полосы пропускания был обусловлен необходимостью обеспечения минимального искажения морфологических особенностей ЭГ с сохранением частотных свойств сигнала. Дополнительно для устранения помех по питанию использовался цифровой режекторный фильтр на 50 Гц, частота дискретизации составляла 1500 Гц.
Параметры проведения электрического импульса возбуждения определялись при расчете значений кросс-корреляционной функции между записанными эндокардиограммами с помощью информационных электродов. Оценка положения пикового значения кросс-корреляционной функции использовалась для расчета временной задержки проведения электрического импульса возбуждения на локальном участке миокарда предсердия (рис. 2). Данный параметр рассчитывался для каждой анатомичсекой точки в режиме «офлайн» с использованием программного пакета Matlab. Эндокардиальные участки миокарда ЛП с задержками проведения электрического импульса более 5 мс были помечены в качестве электроанатомического субстрата и определены их граничные положения (рис. 3).
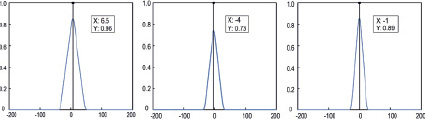
Рис. 2. Значения кросс-корреляционной функции между записанными эндокардиограммами различных электродов катетера
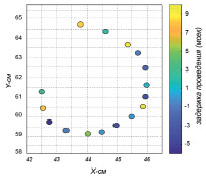
Рис. 3. Карта распределения задержек распространения фронта возбуждения
С целью оценки эффективности разработанного метода анализа биполярных эндокардиограмм для визуализации мишеней электроимпульсного воздействия при лечении ФП были проведены клинические испытания. Применение данного метода при электроанатомическом картировании ЛП пациентов позволило выявить устойчивую периодическую роторную активность у 13 пациентов клинической группы, в остальных случаях источники аритмии имели нестабильный характер. Стимуляция выявленных электроанатомических субстратов левого предсердия электрическими импульсами высокой энергии при катетерной абляции у 8 пациентов привела к купированию ФП.
Заключение
Участки проводящих путей миокарда левого предсердия с измененными электрофизиологическими свойствами провоцируют образование множественных волн микрореентри или роторов, а также обес- печивают их стабильность генерации. Перспективным методом лечения фибрилляции предсердий является селективная катетерная абляция, использующаяся в качестве мишеней интервенционного воздействия области роторной активности миокарда. Разработанный метод анализа биполярных электрограмм используется для локализации ритмогенных зон, катетерное воздействие на которые позволяет устранить фибрилляторную активность при ФП.
Работа выполнена при поддержке гранта РФФИ № 16-37-60012.
 science-review.ru
science-review.ru