Острое нарушение мозгового кровообращения (ОНМК) – патологический процесс в головном мозге, связанный с недостаточностью кровообращения или спонтанным нетравматическим внутричерепным кровоизлиянием. Инсульт является разновидностью ОНМК и представляет собой внезапное появление очаговой неврологической симптоматики и/или общих мозговых нарушений. Данное состояние может сохраняться более 24 ч или приводить к летальному исходу в короткий промежуток времени вследствие причины цереброваскулярного происхождения. Инсульт является одной из основных причин смерти и инвалидности взрослого населения во всем мире. Среди причин смертности в России инсульт занимает третье место. Риск развития инсульта прогрессивно нарастает с увеличением возраста [1, 2].
Профилактика осложнений ОНМК включает в себя профилактику гипостатической пневмонии, мочевых инфекций, тромбоэмболии легочной артерии, тромбоза глубоких вен нижних конечностей, водно-элетролитных и трофических нарушений [2].
В настоящее время наиболее частыми осложнениями ОНМК являются нозокомиальные инфекции, большинство которых имеют бактериальное происхождение. Нозокомиальные инфекции могут вызываться различными возбудителями (облигатные и оппортунистические), которые устойчивы к большинству факторов окружающей среды, быстро приобретая устойчивость к антибиотикам [2, 3].
Среди данных инфекций преобладают инфекции мочевыводящих путей, в 80 % случаев их развитие связано с использованием мочевых дренажей и катетеров, так как острая задержка мочи в остром периоде инсульта развивается у трети больных. Использование антибиотиков широкого спектра действия для профилактики и лечения катетер-ассоциированных инфекций не всегда оказывается эффективным и способствует селекции антибиотикорезистентных штаммов микроорганизмов [2, 3].
Ежегодно регистрируется свыше 18 млн случаев сепсиса в мире, из которых 30 % заканчиваются летальным исходом, при этом нанося экономический ущерб более чем 20 млрд долл. в год. Такой уровень заболеваемости возникает в результате демографического старения населения, большого количества иммунодефицитных состояний, использования химиотерапии при лечении онкологических заболеваний, широкого применения инвазивных процедур. Сепсис является основной причиной смертности пациентов в отделениях интенсивной терапии и реанимации. Смертность от сепсиса в Европе варьирует от 28 % до 41 % [1–3].
Сепсис – патологическое состояние, которое развивается в виде синдрома системной воспалительной реакции (ССВР) в результате попадания в кровь инфекционных агентов. Данный процесс характеризуется полиорганной недостаточностью и тяжелым прогрессирующим течением. Инфекционные агенты могут проникнуть в кровеносное русло различными путями: при генерализации какой-либо местной инфекции или при занесении микроорганизмов извне при оперативных вмешательствах, катетеризации вен и других видах медицинских манипуляций [4].
Возбудителями сепсиса могут быть патогенные, условно-патогенные микроорганизмы: кокки (стафилококки, пневмококки, менингококки), кишечная палочка, синегнойная палочка, микобактерия туберкулеза, клебсиелла, вирусы герпетиформной группы, грибы рода Candida, Aspergillus [3, 4].
От стадии септического процесса будет зависеть клиническая картина и диагностика. При сепсисе имеется очаг инфекции и два или более признаков синдрома системной воспалительной реакции: фебрильная (38 °С и выше), либо нормальная температура тела, тахикардия (90 ударов в минуту и более), учащение частоты дыхания (более 20 в минуту), лейкоцитоз или лейкопения [4].
За последние десятилетия намного улучшились методы диагностики, что позволяет начинать лечение сепсиса в наиболее ранние сроки, однако показатели летальности продолжают увеличиваться. Исходя из этого, одной из ключевых проблем остается установление методик, позволяющих улучшить точность, воспроизводимость и клиническую ценность диагноза сепсиса. Поэтому в настоящее время ведется активный поиск объективных биохимических маркеров сепсиса, так как нет универсального метода своевременной диагностики данного критического состояния [4, 5].
Прокальцитонин впервые был обнаружен французскими военными врачами при измерении уровней биомаркеров у пациентов с обширными ожогами. У больных с высоким содержанием прокальцитонина в крови в дальнейшем развивались инфекционные осложнения, а именно сепсис и септический шок, что объясняло взаимосвязь между высокими уровнями прокальцитонина и системного воспаления [5].
Прокальцитонин является предшественником кальцитонина, пептидного гормона парафолликулярных клеток щитовидной железы. Препрокальцитонин является исходной белковой молекулой, состоит из аминокислотных остатков 1-141, из которой путем протеолиза образуется прокальцитонин, а затем кальцитонин. В свою очередь, прокальцитонин является гликопротеином, состоящим из 116 аминокислот с молекулярной массой 12793 Да. При отсутствии инфекционно-воспалительного процесса из прокальцитонина образуются гормоны (кальцитонин, катакальцин и М-концевой пептид), которые регулируют фосфорно-кальциевый обмен в организме человека.
Определение прокальцитонина является достоверным маркером развития сепсиса у больных, позволяет выбрать необходимую тактику антибактериальной терапии, оценить ее эффективность, определить оптимальную продолжительность лечения и выяснить прогноз заболевания [2, 5].
Главными стимуляторами синтеза прокальцитонина являются бактериальные эндотоксины, индукторами продукции являются липополисахариды грамотрицательных бактерий, которой предшествует повышение уровней провоспалительных цитокинов ИЛ-6, ИЛ-2, ФНО-альфа. При инфекционных заболеваниях прокальцитонин синтезируется за пределами щитовидной железы: в печени, почках, мышцах и в жировых клетках. Затем прокальцитонин выделяется в кровоток, накапливается, его уровень в крови возрастает [3, 4].
Диагностическая ценность маркера определяется тем, что уровень прокальцитонина повышается спустя 3 ч при системной реакции организма на инфекцию. При эффективной антибактериальной терапии происходит быстрое снижение прокальцитонина.
Критерии оценки результатов исследования:
– менее 0,05 нг/ мл – концентрация прокальцитонина в крови здоровых пациентов, отсутствие ССВР;
– <0,5 нг/мл – незначительная ССВР при местных бактериальных инфекциях с легким течением (тонзиллит, отит, цистит, бронхит);
– 0,5 – < 2 нг/мл – достоверная ССВР, умеренной степени. Инфекция возможна. При доказанной инфекции: диагноз сепсиса положительный. Рекомендованы дальнейшие определения уровня прокальцитонина (каждые 6–24 ч);
– >2, но < 10 нг/мл – тяжелая ССВР, сепсис. Высокий риск развития полиорганной недостаточности. При продолжительном повышенном значении (более 4 дней) коррекция терапии. Неблагоприятный прогноз;
– >10 нг/мл – выраженная ССВР вследствие тяжелого бактериального сепсиса или септического шока – данный уровень прокальцитонина часто связан с органной недостаточностью. Нарастание прокальцитонина – показатель неблагоприятного прогноза [1, 2].
Цель исследования: оценка распространенности септических осложнений у пациентов с острым нарушением мозгового кровообращения.
Материалы и методы исследования
Были проведены исследования содержания прокальцитонина у 487 больных с ОНМК отделения реанимации, палаты интенсивной терапии и неврологического отделения на протяжении 2018 г. на базе ГБУЗ ПК ГКБ № 3.
Исследования проводились наборами реагентов для иммуноферментного определения концентрации прокальцитонина в сыворотке (плазме) крови «Прокальцитонин – ИФА – БЕСТ».
Принцип анализа: «sandwich» – вариант твердофазного трехстадийного ИФА на планшетах.
– Количество определений: 96 (разборный вариант планшета). Возможно проведение 12 независимых постановок анализа по 8 определений в каждом, включая контроли.
– Чувствительность: 0,04 нг/мл.
– Диапазон измерения: 0–12,8 нг/мл.
– Исследуемый образец: 20 мкл сыворотки или плазмы.
– Общее время инкубации: 2 ч 30 мин.
– Учет результатов: спектрофотомерия на длине волны 450 нм.
– Срок хранения: 12 месяцев при (2–8) °С.
– Наличие калибраторов и контрольного образца.
Результаты исследования
и их обсуждение
При первичном обследовании больных на содержание прокальцитонина в крови выявлено следующее (таблица).
Содержание прокальцитонина
в сыворотке крови больных ОНМК
|
Содержание |
Количество больных |
% от общего количества больных |
|
менее 0,05 |
88 |
18,1 % |
|
0,05–0,5 |
152 |
31,2 % |
|
0,5–2,0 |
162 |
33,3 % |
|
2,0–10 |
53 |
10,9 % |
|
более 10 |
32 |
6,5 % |
Из таблицы видно, что у достаточно большого процента (18,1 %) больных с ОНМК содержание прокальцитонина не превышало нормальные пределы. Это свидетельствует на данном этапе об отсутствии системной воспалительной реакции. Из этого числа больных повторно было назначено исследование прокальцитонина 36 больным. В последующем у 14 больных отметилось ухудшение состояния и повышенные значения прокальцитонина, что означало развитие более поздних осложнений, присоединение бактериальных инфекций. Так как этим больным была назначена эффективная антибактериальная терапия, цифры значений прокальцитонина быстро пришли в норму.
Содержание прокальцитонина в крови от 0,5 до 2,0 нг/мл (рисунок) было выявлено у большинства больных с ОНМК (33,3 %), что свидетельствует о наличии у них системной инфекции.
Для уточнения диагноза «сепсис» в этих случаях рекомендуется дальнейшее определение прокальцитонина в крови в динамике с частотой повторения через 6–24 ч. Из этой категории больных повторное обследование на содержание прокальцитонина было назначено 83 больным:
– у 42 больных наметилась положительная динамика, что свидетельствует об адекватной антибактериальной терапии, или повышение уровня прокальцитонина было транзиторным вследствие гипоксии;
– у 14 больных зарегистрировано отсутствие динамики, но у этих больных имелись два и более признаков синдрома системной воспалительной реакции;
– у 27 больных зарегистрирована отрицательная динамика в количественном содержании прокальцитонина и наличие очага инфекции и признаков ССВО (синдрома системной воспалительной реакции).
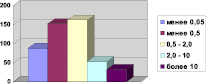
Концентрация прокальцитонина в сыворотке крови больных с ОНМК
Также в дальнейшем были направлены на обследование 68 больных с содержанием прокальцитонина от 0,05 до 0,5 нг/мл. У 13 больных было отмечено повышение прокальцитонина по сравнению с первоначальным, что свидетельствует о генерализации процесса. Динамическое определение прокальцитонина выявило у 9 больных постепенное нарастание цифр в течение продолжительного времени, что определило необходимость интенсивной терапии.
У категории больных с содержанием прокальцитонина от 2,0 до 10 нг/мл была отмечена тенденция к последующему повышению уровня прокальцитонина, что свидетельствовало об инфекционном процессе с системным воспалением, приведшим к сепсису, в результате чего были предприняты соответствующие терапевтические стратегии. Содержание прокальцитонина более 10 нг/мл наблюдалось исключительно у пациентов с тяжелым сепсисом или септическим шоком.
Выводы
1. Прокальцитонин является достоверным ранним маркёром развития сепсиса у больных с острым нарушением мозгового кровообращения, что позволяет своевременно начать эффективную терапию.
2. Исследования концентрации прокальцитонина дают информацию о течении заболевания и позволяют прогнозировать исход болезни.
3. Определение прокальцитонина с учетом анамнеза и клинического состояния пациента позволяет дифференцировать воспалительные процессы бактериальной или вирусной этиологии на ранних этапах.
4. Определение прокальцитонина является одним из самых хронологически быстрых в выполнении лабораторных показателей, что делает этот показатель исключительно ценным в выявлении и диагностике выраженности бактериальных инфекций, оценке эффективности проводимого лечения и мониторирования состояния больных с сепсисом, септическим шоком.
Сепсис у больных с ОНМК является актуальной медико-социальной и экономической проблемой здравоохранения. Данное заболевание представляет собой гетерогенный процесс с выраженной индивидуальной вариабельностью, чем усложняет постановку диагноза и проведение лечения.
Определение прокальцитонина в крови позволяет верифицировать диагноз в ранние сроки, контролировать эффективность процесса лечения, прогнозировать течение заболевания. Выбор алгоритма практического применения биохимических маркеров сепсиса является перспективной клинической задачей, должно использоваться в рутинной практике в отделениях интенсивной и неотложной терапии.
 science-review.ru
science-review.ru