Гемоторакс является одним из наиболее частых последствий травм грудной клетки. Раннее выявление и лечение гемоторакса имеет первостепенное значение для прогноза заболевания. Около 60 % политравм связаны с травмой грудной клетки. По данным ВОЗ ежегодно в мире в результате травм и других несчастных случаев (внешних причин) погибают более 5 миллионов человек. Причем следует отметить, что более 70 % смертности от внешних причин приходится на трудоспособный возраст. Четвертая часть смертей связана с травмой грудной клетки [1].
Цель исследования: определение основных понятий и современных принципов диагностики и лечения гемоторакса для улучшения результатов ведения пациентов с этой патологией.
Этиология. Причины гемоторакса обычно подразделяются на травматические и нетравматические. Травматический гемоторакс является результатом тупой или проникающей травмы. Нетравматический гемоторакс может развиваться при различных заболеваниях или расстройствах, таких как неоплазия, легочная секвестрация, разрыв плеврального сращения в случае пневмоторакса, легочный инфаркт, туберкулез, легочная инфекция (например, геморрагическая лихорадка денге), легочные артериовенозные фистулы и абдоминальные аномалии [2].
Патофизиология. Интраплевральные или экстраплевральные травмы способны привести к гемотораксу. Физиологический ответ на гемоторакс может проявляться в раннем или позднем вариантах. Ранний ответ возможен в двух основных аспектах: гемодинамическом и дыхательном. Поздний ответ проявляется в двух формах: эмпиема и фиброторакс.
Степень тяжести патофизиологического ответа зависит от места повреждения, функционального резерва пациента и объема кровопотери [1].
Гемодинамический ответ является многофакторным ответом и зависит от тяжести гемоторакса в соответствии с его классификацией. Гемоторакс классифицируется в зависимости от количества кровопотери: минимальная, умеренная и массивная.
Минимальный гемоторакс определяется как кровопотеря без значительных гемодинамических изменений. Так, например, кровопотеря до 750 мл у пациента с весом 75 кг обычно протекает без какого-либо значительного гемодинамического ответа и классифицируется как минимальный гемоторакс. Гемодинамический ответ часто корректируется в зависимости от количества кровопотери, основного заболевания и места повреждения.
Если у пациента в плевральной полости уже имеется спаечный процесс, спайки могут ограничивать количество кровопотери, особенно из источников низкого давления, и способны спасти жизнь.
Кровопотеря более 30 % объема крови (1500–2000 мл) обычно связана с геморрагическим шоком (массивным гемотораксом) [3].
Респираторный ответ. На респираторную реакцию влияют многочисленные факторы. Дыхательная недостаточность, связанная с травмой, может возникнуть прямо или косвенно.
Косвенными причинами дыхательной недостаточности являются легочная инфекция, фиброторакс как позднее осложнение и травмы у пациентов с основным заболеванием.
Дыхательная недостаточность, связанная непосредственно с травмой, возникает в результате прямого повреждения легких, грудной стенки и сердца или системного ответа в форме ОРДС в результате диффузного альвеолярного повреждения с увеличением проницаемости капилляров [4].
Физиологическое разрешение гемоторакса. Дефибринация гемоторакса начинается через несколько часов после его образования. Некоторая степень дефибринации гемоторакса приводит к неполному свертыванию. После того как произошел лизис гемоторакса путем воздействия плевральных ферментов, увеличивается концентрация белка. Внутриплевральное гиперосмотическое давление создает положительный осмотический градиент и способствует образованию плеврального выпота.
Таким образом, относительно небольшое количество крови в плевральной полости может создавать эффект, аналогичный влиянию хронических субдуральных гематом, с течением времени втягивая жидкости и вызывая большой выпот с небольшим фактическим содержанием крови [3].
Поздняя физиологическая системная реакция. К поздним физиологическим реакциям гемоторакса относятся эмпиема и фиброторакс.
Первичное или вторичное инфицирование гемоторакса завершается эмпиемой. Бронхотрахеальные повреждения, травмы пищевода, диафрагмальные и субдиафрагмальные повреждения, скопление жидкости в субдиафрагмальной области и постхирургическое инфицирование способствуют развитию посттравматической эмпиемы (рис. 1) [5].
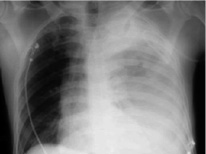
Рис. 1. Рентгенография грудной клетки; левосторонний гемоторакс после тупой травмы
Фиброторакс возникает в результате отложения фибрина на плевральных поверхностях. Недренируемая плевральная жидкость независимо от ее происхождения вызывает воспалительный ответ и приводит к воспалительному процессу на поверхности висцеральной и париетальной плевры. Стенки грудной клетки и диафрагма также поражаются аналогичным процессом, что в целом приводит и к поражению легочной ткани. Поражение легких ограничивает дыхательную функцию и, как правило, уменьшает объем легких [6].
Клинические проявления. При травмах грудной клетки клинические проявления зависят от механизма повреждения и перечня вовлеченных органов. Пациенты, перенесшие тупую травму грудной клетки, подвергаются значительному риску, который связан с характером травмы, осложнениями и смертностью [7]. В отличие от проникающей травмы грудной клетки биомеханическая сила, необходимая для получения значительного тупого повреждения грудной клетки, часто приводит к множественным травмам, включая травмы живота, головы и конечностей [8].
Тупые травмы грудной клетки. Тупые травмы грудной клетки могут вызывать гемоторакс, ушиб легкого, разрыв легочной артерии, травматическую легочную псевдокисту, легочную гематому, травматическую асфиксию и повреждения костного скелета. Множественные переломы ребер являются наиболее распространенными последствиями при тупых травмах грудной клетки и встречаются примерно в 36–50 % случаев (около 36 % с правой стороны и 51 % с левой стороны).
Небольшой гемоторакс может быть пропущен во время физического обследования и даже рентгенографии грудной клетки.
Повреждения грудной стенки подразделяются на простые и сложные.
Простые повреждения грудной стенки состоят из менее чем трех переломов ребер и поверхностных повреждений мягких тканей. Этот тип травмы обычно можно лечить консервативно.
Переломы трех или более ребер и флоттирующий перелом грудной клетки относятся к категории сложных повреждений грудной стенки и часто могут быть связаны со значительной степенью гемоторакса.
Гемоторакс может развиться через некоторое время после получения травмы. Возможным механизмом развития отсроченного гемоторакса является смещение сломанных ребер с разрывом паренхимы легких, повреждением диафрагмы или разрывом межреберных сосудов [1, 9].
Тупые внутригрудные травмы. Повреждения сосудов при тупых внутригрудных травмах обычно приводят к большим гемотораксам. Разрыв больших сосудов и травмы сердца могут привести к кровотечениям в плевральное пространство и последующей сосудистой ишемии. Реже при небольших сосудистых повреждениях могут возникать кровяные сгустки, которые способны остановить кровотечение.
В зависимости от характера и локализации повреждения меняется симптоматика, которая варьирует от менее тяжкой до тяжелой. Респираторные проявления, связанные с большим гемотораксом, а также тупость при перкуссии и отсутствие дыхательных шумов отмечаются как типичные признаки и симптомы при этой патологии [1, 4, 10].
Проникающая травма. Наиболее распространенной причиной гемоторакса при проникающих ранениях является прямое повреждение сосудов грудной клетки. Также не следует упускать из виду и повреждения других внутригрудных структур, включая повреждения паренхимы сердца и легких. Травма паренхимы легких при проникающих ранениях грудной клетки очень распространена и обычно самоограничена, но эти повреждения обычно приводят к гемопневмотораксу (рис. 2) [11].
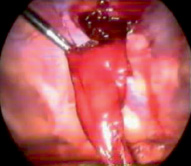
Рис. 2. Гемоторакс при проникающей травме. Рана, прикрытая сгустком, при удалении которого кровотечение возобновляется
Клинические проявления при травматическом гемотораксе. В случае травмы грудной клетки следует провести тщательный и точный медицинский осмотр. Кровь в плевральной полости распространяется в положении лежа на спине и может быть легко пропущена во время физикального осмотра. Настоятельно рекомендуется также выполнять физикальное обследование пациента в вертикальном положении или в небольшом обратном положении Тренделенбурга, чтобы выявить меньшие гемотораксы. Менее 500 мл крови в костофреническом угле можно не заметить при физикальном обследовании (рис. 3).
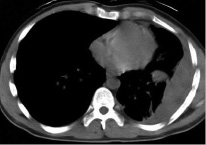
Рис. 3. Левосторонний гемоторакс и ателектаз левой нижней доли
Гемоторакс также может возникнуть в результате внутрибрюшной травмы. Возможность повреждения органов брюшной полости, например селезенки, печени, желудка или сосудов, должна быть рассмотрена в каждом случае гемоторакса и особенно в случае встречающегося диафрагмального повреждения [12].
Лечебно-диагностическая система. Лечение гемоторакса подразделяется на периоды: в раннюю фазу (к примеру, при геморрагическом шоке, нарушениях дыхания или свернувшемся гемотораксе) и в позднюю фазу (при фибротораксе и эмпиеме плевры).
При малом гемотораксе (определяемом как <300 мл) лечения не требуется, так как кровь обычно самостоятельно рассасывается в течение нескольких недель. Если пациент стабилен и имеет минимальные дыхательные расстройства, то в этих случаях хирургического вмешательства не требуется. Такой группе больных по мере необходимости назначаются обезболивающие препараты и проводится динамическое наблюдение с повторной рентгенографией грудной клетки через 4–6 часов и 24 часа [13]. В случаях возникновения легочных паренхиматозных свищей после торакоцентеза следует рассмотреть возможность торакоскопических манипуляций.
В соответствии с клиническим руководством Advanced Trauma Life Support (ATLS) наличие 1500 мл и более крови в плевральной полости или динамическое поступление более 250 мл крови ежечасно в течение трех часов подряд через дренажную трубку являются показаниями для хирургического вмешательства при проникающих повреждениях грудной клетки. Эти критерии, однако, не являются обязательными. Также показаниями для хирургического вмешательства служат определенные состояния при таких поздних осложнениях гемоторакса, как эмпиема плевры и фиброторакс. Неотложная торакотомия показана при необходимости адекватной экспозиции всей плевральной полости [14].
Дренирование плевральной полости по Бюлау. Торакоцентез как метод окончательного лечения гемоторакса менее эффективен. В современных условиях предпочтительно применение полной эвакуации сгустков крови при торакотомии с дренированием плевральной полости или при видеоассистированной торакоскопии (ВАТС) [15].
Адекватное управление гемотораксом требует полной эвакуации крови. Для достижения этой цели обычно достаточно трубок с 24 или 28 делениями по французской шкале дренажей грудной клетки [16].
Неполное или неэффективное трубочное дренирование, особенно в случаях выраженных плевральных спаек, противопоказано. В таких случаях более безопасными являются ВАТС или торакотомия с рассечением спаек [17].
Дренаж у пациентов с коагулопатией. Дренирование плевральной полости при гемотораксе в случаях коагулопатии следует проводить с учетом основного заболевания. Перед проведением торакоцентеза для дренирования плевральной полости необходимо осуществить коррекцию функции гемокоагуляции при соответствующем клиническом статусе пациента. Игольчатая аспирация в случае нелеченной коагулопатии противопоказана [17].
Видеоассистированная торакоскопия (ВАТС) обеспечивает полный обзор плевральной полости с возможностью коррекции внутриплевральной дренажной трубки – размещения, контроля кровотечений и удаления оставшегося сгустка [18]. Большинство авторов рекомендуют ВАТС в случае гемоторакса с наличием более чем 300 мл вследствие более благоприятных результатов по сравнению с пациентами, которые не получали ВАТС [15, 17–19].
Торакотомия. В критической ситуации при массивном гемотораксе и подозрении на ранение сердца или магистральных сосудов необходимо проводить торакотомию. Выбор разреза при экстренной торакотомии зависит от многих факторов, включая особенности показаний к оперативному вмешательству, механизм повреждения и результаты рентгенологических исследований.
Показания для срочной торакотомии по протоколу ATLSAT:
– при дренировании грудной клетки: начальное поступление не менее 1500 мл крови или поступление по дренажу не менее 200 мл крови в час;
– большой неэвакуируемый свернувшийся гемоторакс;
– развивающаяся тампонада сердца;
– дефект грудной клетки;
– большая утечка воздуха или неполное расширение легких, несмотря на адекватный дренаж;
– травмы крупных сосудов;
– травмы пищевода;
– травмы диафрагмы;
– травмы сердца.
В неотложных ситуациях необходимо проводить срочную интубацию трахеи для предотвращения аспирации дыхательных путей. Торакотомия иногда требуется в случаях III стадии эмпиемы согласно классификации ATS (Американское торакальное общество) [20].
Относительно лечебной тактики при травматическом свернувшемся гемотораксе существуют противоречивые точки зрения – от консервативной терапии до хирургического вмешательства. В настоящее преобладает мнение о применении раннего торакоскопического вмешательства (ВАТС) с эвакуацией кровяного сгустка и мобилизацией легкого для его расправления. Ранняя ВАТС значительно уменьшает количество поздних осложнений гемоторакса и оказывает положительное влияние на продолжительность пребывания в стационаре и выживаемость пациентов, особенно у пожилых людей. Клинические результаты у пациентов, перенесших раннюю видеоассистированную торакоскопию, превосходили результаты, полученные у пациентов, которым не применяли раннюю ВАТС [21, 22].
Торакоскопическая хирургия с использованием видео на сегодняшний день является более эффективным методом лечения свернувшегося гемоторакса в сравнении с другими методами. Однако ВАТС часто недоступно во многих лечебных учреждениях. Одной из легкодоступных и эффективных альтернатив ВАТС является использование интраплеврального фибринолиза (IPF) [16, 22]. Однако при сравнительном анализе полученных результатов ВАТС и IPF была доказана более высокая эффективность ВАТС – как с точки зрения уменьшения времени пребывания в стационаре, так и необходимости торакотомии (рис. 4).
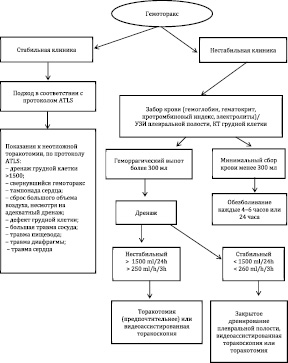
Рис. 4. Алгоритм диагностического и терапевтического подхода к гемотораксу
Осложнения. Неадекватное или некорректное расположение дренажных грудных трубок приводит к недостаточному дренажу гемоторакса. Инфицирование длительно сохраняющегося кровяного сгустка при наличии торакостомического дренирования или недренированного гемоторакса может привести к эмпиеме [16]. Фиброторакс развивается как позднее осложнение воспаления висцеральной и париетальной плевры и снижает дыхательную функцию. Для ликвидации фиброторакса наиболее эффективной является декортикация висцеральной плевры, обеспечивающая расправление легкого [1, 10, 12].
Заключение
Лечение гемоторакса подразделяется на периоды: в раннюю фазу при геморрагическом шоке, нарушениях дыхания или свернувшимся гемотораксе и в позднюю фазу при фибротораксе и эмпиеме плевры.
Решение о ранней ликвидации остаточного гемоторакса / кровяных сгустков при помощи ВАТС значительно снижает поздние осложнения, такие как эмпиема, фиброторакс и необходимость поздней вторичной торакотомии. Кроме того, раннее применение ВАТС сокращает продолжительность пребывания в стационаре по сравнению с дренированием плевральной полости или консервативным лечением гемоторакса. Сонография живота при травме грудной клетки должна проводиться регулярно [1, 2, 5, 6, 8].
 science-review.ru
science-review.ru