Продукция БЛРС (бета-лактамаз расширенного спектра) у нозокомиальных штаммов семейства Enterobacteriaceae, особенно у Klebsiella pneumoniae и E. coli является одним из наиболее частых и значимых механизмов резистентности к антибактериальным препаратам в стационарах России. В настоящее время описано более 350 бета-лактамаз, из них более 100 обуславливает резистентность к цефалоспоринам I–IV поколения и азтреонаму. Штаммы, вырабатывающие БЛРС, также часто имеют гены резистентности к аминогликозидам, фторхинолонам, ко-тримоксазолу [1].
При изучении распространенности бета-лактамаз расширенного спектра у нозокомиальных штаммов в различных стационарах России в 1997–1998 гг. и в 2003 г. было установлено, что частота встречаемости БЛРС существенно отличается по регионам РФ, между стационарами одного города, даже между отделениями одного стационара. Так в восьми стационарах г. Москвы были обнаружены БЛРС у 10,0; 16,7; 17,0; 23,7; 26,5; 58,3; 87,1 и 90,0 % штаммов соответственно [2].
Частота распространенности БЛРС-продуцирующих энтеробактерий в стационарах некоторых городов России [3] за 2003 г. представлена в табл. 1.
Таблица 1
Частота распространенности штаммов энтеробактерий, продуцирующих БЛРС, в стационарах некоторых городов России
|
№ п/п |
Название городов |
Частота выделения ( %) |
|
1 |
Санкт-Петербург |
80,3 |
|
2 |
Москва |
56,3 |
|
3 |
Смоленск |
63,6 |
|
4 |
Воронеж |
57,1 |
|
5 |
Краснодар |
92,3 |
|
6 |
Ставрополь |
100,0 |
|
7 |
Казань |
50,0 |
|
8 |
Пермь |
20,5 |
|
9 |
Екатеринбург |
76,5 |
|
10 |
Тюмень |
60,0 |
|
11 |
Томск |
51,2 |
|
12 |
Омск |
63,0 |
|
13 |
Красноярск |
64,5 |
|
14 |
Новосибирск |
82,1 |
|
15 |
Иркутск |
66,7 |
|
16 |
Владивосток |
80,0 |
Из таблицы видно, что частота выделения штаммов, продуцирующих БЛРС, в стационарах некоторых городов России очень высокая. Распространенность в среднем по России Klebsiella pneumoniae составляет от 60,2 % до 84,3 %, E. coli – от 15,8 % до 54,7 % [3].
Бета-лактамазы расширенного спектра в настоящее время широко распространены в большинстве стран мира. Частота обнаружения БЛРС у штаммов Klebsiella pneumoniae и E. coli в некоторых странах [4–6] представлена в табл. 2.
Таблица 2
Частота обнаружения БЛРС в некоторых странах мира
|
№ п/п |
Название стран |
Частота обнаружения ( %) |
|
|
Klebsiella pneumoniae |
E. coli |
||
|
1 |
Африка |
– |
16,2 |
|
2 |
Европа |
23,4–32,8 |
14,4–18,8 |
|
3 |
Индия |
56,0 |
– |
|
4 |
Иран |
39,0–50,0 |
– |
|
5 |
Канада |
5,0 |
– |
|
6 |
Латинская Америка |
45,0 |
23,3 |
|
7 |
США |
8,0 |
7,4 |
|
8 |
Саудовская Аравия |
55,0 |
– |
|
9 |
Турция |
39,4 |
– |
Из таблицы видно, что самая низкая частота встречаемости БЛРС продуцирующих штаммов в Канаде, США и Европе, а самая высокая – в странах Азии, Латинской Америке, Саудовской Аравии.
Резистентность энтеробактерий приобретает все большее распространение и является серьезной проблемой в здравоохра- нении.
Цель работы: изучить распространенность нозокомиальных штаммов Klebsiella pneumoniae и E. coli, продуцирующих БЛРС и их антибиотикорезистентность в детском стационаре Тульской области для проведения более рациональной и эффективной антибактериальной терапии.
Материалы и методы исследования
Материалом для исследования служил биологический материал (моча, кал, мазки из зева и носа, кровь на стерильность и прочее), полученный от детей, находящихся на лечении в детском стационаре ГУЗ «Тульская детская областная клиническая больница» в 2017–2019 гг.
Выделение чистых культур Klebsiella pneumoniae и E. coli проводили классическим бактериологическим методом, а видовую идентификацию, определение БЛРС и чувствительность к антибиотикам – с помощью автоматизированной микробиологической системы Phoenix-100, производителем которой является компания Becton Dickinson (США).
Результаты исследования и их обсуждение
Всего за 2017–2019 гг. было выделено от детей 1017 штаммов (460 – Klebsiella pneumonia, 557 – E. coli) из различного биологического материала (кал, моча, мазки из зева и др.). При изучении пейзажа выделенных культур, продуцирующих БЛРС, установлено, что наибольший удельный вес приходится на Klebsiella pneumonia (50 %) и E. coli (38 %), на другие энтеробактерии – 12 % (рис. 1).
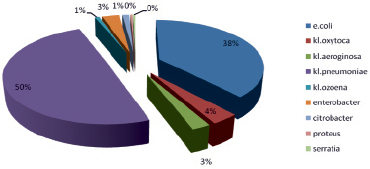
Рис. 1. Пейзаж выделенных культур-продуцентов БЛРС за 2017–2019 гг.
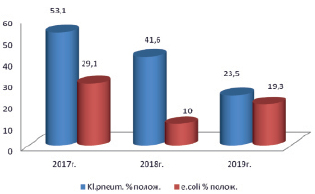
Рис. 2. Частота встречаемости БЛРС продуцирующих Klebsiella pneumonia и E. coli за 2017–2019 гг.
Частота БЛРС-позитивных штаммов у Klebsiella pneumoniae составила от 23,5 % до 53,1 %; у E. coli – от 10 % до 29,1 %.
Количество штаммов Klebsiella pneumoniae, продуцирующих бета-лактамазы расширенного спектра, в 2 раза больше, чем штаммов E. coli. Частота встречаемости штаммов, продуцирующих БЛРС, за 2017–2019 гг. представлена на рис. 2.
Мы видим, что в 2019 г. наметилась тенденция к снижению БЛРС продуцирующих штаммов Klebsiella pneumoniae и E. coli.
Частота встречаемости штаммов, продуцирующих бета-лактамазы расширенного спектра, отличается не только по годам, но и по отделениям детского стационара. Наибольшая частота встречаемости – в отделении анестезиологии и реанимации (около 90 %), педиатрическом – до 48 %, отделении патологии новорожденных (ОПН) – 37 %, нефрологическом – 5,8 %. Самая низкая встречаемость нозокомиальных штаммов-продуцентов БЛРС – в нефрологическом отделении.
Антибиотикорезистентность к бета-лактамным и небета-лактамным препаратам представлена в табл. 3.
Таблица 3
Антибиотикорезистентность штаммов, продуцирующих БЛРС в 2019 г.
|
Название антибиотиков |
Klebsiella pneumonia |
E. coli |
|
|
R( %) |
R( %) |
||
|
Пенициллины |
|||
|
1 |
Амоксициллин/Клавуланат |
40,68 |
35,98 |
|
2 |
Амипициллин/Сульбактам |
33,33 |
30,43 |
|
3 |
Пиперациллин/Тазобактам |
17,59 |
7,0 |
|
Цефалоспорины |
|||
|
4 |
Цефотаксим |
72,73 |
40,74 |
|
5 |
Цефтазидим |
43,94 |
31,36 |
|
6 |
Цефтриаксон |
42,11 |
36,0 |
|
7 |
Цефиксим |
86,49 |
62,0 |
|
8 |
Цефепим |
48,76 |
34,38 |
|
9 |
Цефоперазон/Сульбактам |
0 |
5,8 |
|
Аминогликозиды |
|||
|
10 |
Амикацин |
6,25 |
17,47 |
|
11 |
Гентамицин |
17,48 |
16,57 |
|
12 |
Нетилмицин |
21,05 |
21,43 |
|
13 |
Тобрамицин |
27,78 |
29,0 |
|
Карбапенемы |
|||
|
14 |
Имипенем |
5,08 |
2,96 |
|
15 |
Меропенем |
13,28 |
8,33 |
|
16 |
Эртапенем |
27,35 |
13,58 |
|
Другие группы |
|||
|
17 |
Триметоприм |
38,94 |
40,87 |
|
18 |
Фосфомицин |
16,67 |
7,04 |
Из таблицы видно, что наиболее распространенной была резистентность к цефалоспоринам III–IV поколения (цефотаксиму, цефтазидиму, цефтриаксону, цефиксиму, цефепиму), ингибиторозащищенным пенициллинам (амоксициллин/клавуланат, ампициллин/сульбактам) и триметоприму.
Наиболее активными препаратами в отношении E. coli среди бета-лактамных препаратов были пиперациллин/тазобактам (93 %) и карбопенемы: имипенем (97 %), меропенем (91,7 %) и небета-лактамный препарат – фосфомицин (93 %).
Klebsiella pneumoniae была более чувствительна к имипенему (95 %) и из класса аминогликозидов – амикацину (93,8 %).
Отмечается высокая чувствительность Klebsiella pneumoniae и E. coli к цефоперазону/сульбактаму (100 % и 94 %) соответственно.
Выводы
Выявлена распространенность нозокомиальных штаммов Klebsiella pneumoniae и E. coli, продуцирующих БЛРС в детском стационаре, которая составляет от 23,5 % до 53,1 % и от 10 % до 29,1 % в разные годы соответственно. Частота встречаемости Klebsiella pneumoniae в детском стационаре в 2 раза больше, чем у штаммов E. coli. Наметилась положительная тенденция в 2019 г. к снижению БЛРС продуцирующих нозокомиальных штаммов Klebsiella pneumoniae и E. coli.
Наибольшая частота встречаемости Klebsiella pneumoniae и E. coli в отделении анестезиологии и реанимации, отделении патологии новорожденных, педиатрическом отделении. Наименьшая частота встречаемости нозокомиальных штаммов, продуцирующих БЛРС – в нефрологическом отделении.
Отмечается высокая антибиотикорезистентность у штаммов-продуцентов БЛРС к ингибиторозащищенным пенициллинам, цефалоспоринам III–IV поколения и триметоприму.
Также отмечается высокая чувствительность Klebsiella pneumonia к имипенему (95 %), амикацину (93, 8 %) и цефоперазону/сульбактаму (100 %).
Наиболее активными препаратами в отношении E. coli являются пиперациллин/тазобактам (93 %), цефоперазон/сульбактам (94 %), имипенем (97 %), меропенем (91,7 %), фосфомицин (93 %).
Таким образом, необходимо проводить своевременную и регулярную диагностику бета-лактамаз расширенного спектра среди энтеробактерий, которая способствует проведению рациональной и эффективной антибактериальной терапии.
 science-review.ru
science-review.ru