Патологическое накопление жидкости в плевральной полости, называемое гидротораксом, может быть одним из осложнений декомпенсированного цирроза печени (ЦП). Одним из наиболее первых, клинически значимых, осложнений ЦП является асцит, примерно в 10–20 % асцит не поддается медикаментозной коррекции [1]. Печеночный гидроторакс (ПГ) – это скопление плевральной жидкости в объеме, превышающем 500 мл у пациентов с ЦП, при этом исключено наличие сопутствующей патологии сердца и легких [2]. ПГ встречается реже, чем асцит, примерно, у 15 % пациентов с циррозом и в 25 % случаев течение гидроторакса рефрактерно к консервативному лечению [3]. Даже небольшой объем гидроторакса может вызвать клинические проявления дыхательной недостаточности. Когда течение асцита и ПГ не поддается стандартному лечению, появляется необходимость в хирургических манипуляциях, направленных на эвакуацию жидкости (парацентез, торакоцентез). Данные процедуры ложатся тяжким бременем как на пациентов, так и на систему здравоохранения. Согласно практическим рекомендациям 2009 г. Американской ассоциации по изучению заболеваний печени, постановка дренажа в брюшную и плевральную полости противопоказана, так как это достоверно приводит к увеличению смертности [4]. Однако данные рекомендации сделаны без полного описания типа дренажной системы и не указывают цели манипуляции.
В 2016 г. произведено исследование, в котором были получены положительные результаты катетеризации плевральной полости у пациентов с ЦП, которые были кандидатами на трансплантацию печени [5]. В статье приводилось наблюдение 24 пациентов, из них у 4 (16,7 %) возникло инфицирование плевральной полости, трем из которых это не помешало успешно произвести трансплантацию печени [5]. У 8 пациентов (33,3 %) имел место спонтанный плевродез, что позволило удалить дренаж из грудной полости [5].
Основным патогенетическим звеном в развитии асцита является портальная гипертензия. Печень является единственным органом, синтезирующим альбумин, таким образом, поражение печени приводит к гипоальбуминемии, что ведет к снижению онкотического давления, что также ведет к образованию асцита. В последнее время общепринятой является гипотеза периферической артериальной вазодилятации [6]. Портальная гипертензия увеличивает поступление вазодилятаторов в кровяное русло, что постепенно ведет к застою крови в сосудах органов брюшной полости. Данное состояние вызвано активацией симпатической нервной системой, ренин-ангиотензин-альдостероновой системы, секрецией вазопрессина, что ведет к задержке натрия и выходу жидкости во внесосудистое пространство, в частности в брюшную полость [6]. Другим источником вазодилятаторов может быть кишечник, когда продукты жизнедеятельности бактерий стимулируют высвобождение провоспалительных цитокинов, что ведет к расширению сосудов органов брюшной полости [6].
Причина образования ПГ при ЦП описана несколькими теориями, в том числе нарушение пластической функции печени и, как следствие, снижение онкотического давления за счет гипоальбуминемии, повышение гидростатического давления в системе непарной вены, трансдиафрагмальная миграция асцитической жидкости в плевральную полость [7]. Несмотря на это, наиболее общепринятой является теория поступления жидкости из брюшной полости через дефекты в диафрагме. Данные дефекты диафрагмы были описаны и классифицированы P.M. Huang et al., который также предложил торакоскопическое закрытие дефектов сеткой [8]. Данная теория также не противоречит изолированному ПГ, так как при этом скорость реабсорбции асцита плевральной полостью равна образованию асцита брюшной полостью [9].
Согласно современным клиническим рекомендациям, именно тяжесть асцита определяет его лечение [10]. Соответственно, пациенты с ЦП и лёгкой степенью асцита не нуждаются в терапии диуретиками и в диете с низким содержанием соли. Поскольку со временем экскреция натрия у пациентов ухудшается, степень асцита переходит в умеренную, а целью лечения становится снижение потребления Na+ и стимуляция его выведения с помощью диуретиков и специального режима питья. Пациентам с ПГ и напряженным асцитом рекомендовано проведение парацентеза и инфузия альбумина из расчёта 8 г на каждый эвакуированный литр асцитической жидкости. Рефрактерный асцит – это состояние, при котором свободную жидкость в брюшной полости не удается мобилизовать диуретическими средствами, ограничением соли, а также рецидив асцита после парацентеза, несмотря на медикаментозное лечение. В случае рецидива асцита процедуру можно повторять каждые 2–3 недели, комбинируя ее с инфузией альбумина [11].
Пункция плевральной полости применяется у пациентов с ПГ, резистентных к консервативному лечению, при наличии клинических признаков плеврального выпота, таких как одышка и сухой кашель. При декомпенсированном состоянии ЦП эффект от торакоцентеза кратковременный, что ведет к необходимости повторных пункций. Эвакуация плевральной жидкости, в свою очередь, ведет к потере белка и электролитов. Стоит упомянуть, что сам торакоцентез несет в себе такие осложнения, как пневмоторакс, кровотечение, инфицирование плевральной полости, повреждение печени и селезенки, болевой шок и отек лёгкого, вероятность которых возрастает с каждой повторной процедурой [12]. К дренированию плевральной полости необходимо подходить с крайней осторожностью, так как существует риск таких осложнений, как обильная потеря белка, вторичная инфекция, пневмоторакс, гемоторакс, печеночно-почечный синдром, нарушение электролитного баланса [13]. Традиционно считалось, что показаниями к дренированию плевральной полости являются эмпиема плевры и пневмоторакс. Сейчас данная процедура стала общепринятой в лечении пациентов с рецидивными и рефрактерными плевральными выпотами, при этом затяжное нахождение трубки в грудной полости удается прервать индукцией плевродеза. Химический или медикаментозный плевродез – это искусственная инициация асептического воспаления париетального и висцерального листка плевры путем введения местнораздражающего вещества. В результате чего происходит нивелирование плевральной полости и, как следствие, такие состояния, как плевральный выпот и пневмоторакс, не имеют место быть. Плевросклерозант вводится в плевральную полость либо через дренаж, либо во время лечебно-диагностической плевроскопии или торакоскопии. Наиболее распространенными химическими веществами являются тальк, тетрациклин и его производные, йодповидон, нитрат серебра, цитостатические препараты [14].
Цель исследования: оценить эффективность применения ХП йодповидоном у пациентов с рефрактерным плевральным выпотом при ЦП в сочетании с таким осложнением, как асцит. На основании показателей гемодинамики, температурной и болевой реакции установить, безопасен ли данный метод плевродеза. Отметить особенности проведения плевродеза при сочетанном наличии асцита и плеврального выпота.
Материалы и методы исследования
Исследование проводилось на базе клиники имени И.К. Ахунбаева Национального госпиталя при Министерстве здравоохранения Кыргызской Республики. Стоит отметить, что в данном медицинском учреждении располагается ведущее отделение торакальной хирургии республики. В период с сентября 2019 г. по октябрь 2021 г. на стационарном лечении в отделении находилось 12 пациентов с циррозом печени различной этиологии в возрасте от 41 до 67 лет, из них 6 мужчин (50 %) и 6 женщин (50 %). Все пациенты находились на постоянном наблюдении у гастроэнтеролога, периодически проходя коррекцию лечения стационарно. Несмотря на это, у больных развились такие осложнения, как портальная гипертензия, асцит и гидроторакс. Правосторонний гидроторакс имел место во всех 12 случаях, из них в 3 случаях (25 %) было отмечено наличие небольшого выпота в левой плевральной полости.
В стадии декомпенсации ЦП, невзирая на коррекцию медикаментозного лечения, у пациентов развивалась клиника дыхательной недостаточности, с целью ее купирования проводились процедуры торакоцентеза, больные, у кого течение ПГ носило рецидивный и рефрактерный характер, были госпитализированы в отделение торакальной хирургии для проведения процедуры ХП. Учитывая, что ранее индукция плевродеза не проводилась и данный способ лечения не входит в протоколы Министерства здравоохранения Кыргызской Республики, у всех пациентов было взято информированное согласие.
В исследование не были включены пациенты с аллергическим анамнезом к препаратам йода, заболеваниями щитовидной железы, ригидным легким и пациенты с ожидаемой продолжительностью жизни менее 30 дней.
Методика ХП включала в себя дренирование плевральной полости, обезболивание листков плевры, и сама процедура плевродеза проводилась только после полного расправления легкого, подтвержденного рентгенографически. Местная анестезия достигалась путем введения через плевральный дренаж 50 мл 1 % раствора лидокаина, экспозиция составляла 20 мин. Далее анестетик из плевральной полости удалялся, и внутриплеврально вводилось 20 мл 10 % раствора йодповидона, дренаж перекрывался на 2 ч, для достижения максимальной площади воздействия больным рекомендовано периодическое изменение положения тела и активные дыхательные движения.
Оценка эффективности заключалась в уменьшении количества отделяемого по дренажу до 100 мл и, как следствие, возможности удаления дренажа из плевральной полости. Пациенты после выписки находились на амбулаторном наблюдении торакального хирурга, контрольные осмотры проводились через 1, 3 и 6 месяцев, далее раз в год. Безопасность процедуры контролировалась путем фиксации основных показателей гемодинамики, температурной реакции и болевых ощущений.
Результаты исследования и их обсуждение
Статистическая обработка данных проводилась с помощью программы IBM Statistics 28.0.
Причиной ЦП в 11 случаях (91,7 %) стал хронический вирусный гепатит, в 1 случае (8,3 %) причиной стал первичный билиарный цирроз печени. У 9 пациентов (75 %) на момент обращения имел место субтотальный уровень жидкости, у 2 пациентов (16,7 %) правый гемоторакс был затенен полностью, у 1 пациента (8,3 %) на рентгенографии обнаружен гидропневмоторакс с тотальным коллапсом правого легкого (рисунок), что, вероятнее, стало осложнением многочисленных пункций плевральной полости. С целью предупреждения смещения средостения эвакуация жидкости из грудной полости производилась поэтапно, объем жидкости за первые сутки составил от 2800 мл до 4100 мл. Ежесуточный объем отделяемой жидкости составил от 350 до 1400 мл. У всех пациентов диагностировано наличие асцита различной степени тяжести: умеренный асцит в 9 случаях (75 %) и в 3 случаях (25 %) имел место асцит тяжелой степени.
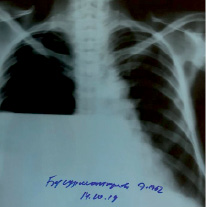
Правосторонний гидропневмоторакс. Рентгенограмма в прямой проекции, где отмечается наличие горизонтального уровня жидкости с верхней границей у переднего отрезка III ребра
В 6 случаях (50 %) ХП был произведен без предварительной эвакуации жидкости из брюшной полости. Таким образом, не был достигнут минимальный объем ежедневной экссудации в 100 мл, который мог бы позволить удалить дренаж из плевральной полости. Все 6 пациентов были выписаны на амбулаторное наблюдение и лечение с дренажными трубками из плевральной полости. Стоит отметить, что данная когорта пациентов находилась на стационарном лечении в торакальном отделении хронологически раньше. Безуспешность ХП можно объяснить непрерывной миграцией асцитической жидкости в плевру и, как следствие, изменением концентрации действующего вещества. В результате амбулаторного наблюдения у 2 пациентов (33,3 %) поступление жидкости прекратилось в течение 12 и 14 дней без дальнейшего рецидива, у 4 пациентов (66,7 %) в результате длительного нахождения плевральной трубки развилась эмпиема плевры, что в 3 случаях привело к облитерации плевры в течение одного месяца, в 1 случае после разрешения эмпиемы плевры и удаления дренажа имел место рецидив эмпиемы через 3 месяца. Данные об эффективности ХП представлены в табл. 1.
Таблица 1
Сравнение эффективности ХП у пациентов с ЦП без лапароцентеза и с лапароцентезом (p < 0,05)
|
Наименование группы |
Количество пациентов |
Количество дней до удаления дренажа после ХП |
Наличие осложнений от дренирования (эмпиема плевры) |
Число рецидивов |
|
ХП без предварительного лапароцентеза |
6 |
22,5 ± 8,4 |
4 (66,7 %) |
1 |
|
ХП с предварительным лапароцентезом |
6 |
2,7 ± 0,5 |
0 |
0 |
|
Общее число |
12 |
4 (33,3 %) |
1 (8,3 %) |
В оставшихся 6 случаях ХП был проведен после предварительного лапароцентеза, эффект от которого был достигнут в течение 72 ч после введения плевросклерозанта, что позволило удалить дренаж и выписать пациента, эффективность, таким образом, составила 100 %.
Во время исследования не наблюдалось тяжелых осложнений как после эвакуации жидкости, так и после введения химического агента. Во время нахождения в стационаре лечение пациентов проводилось в комплексе, включающем медикаментозное лечение основного заболевания, коррекцию водно-электролитного и белкового баланса, диету с ограничением соли и питьевой режим.
После введения йодповидона в плевральную полость пациенты оценивали болевую чувствительность по визуально-аналоговой шкале (ВАШ), в 2 случаях (16,7 %) больные отмечали умеренную постоянную боль, которая была купирована однократной инъекцией нестероидного противовоспалительного средства (НПВС), в остальных 10 случаях (83,3 %) болевые ощущения были менее интенсивные и необходимости в НПВС не было. Субфебрильная температурная реакция в первые 24 ч после введения плевросклерозанта была отмечена в 6 случаях (50 %), в 1 случае (8,3 %) температура повысилась до 38,6 °С, пиролитический эффект был достигнут однократным приемом парацетамола. Стоит отметить, что температура тела нормализовалась в течение 24–48 ч после ХП (p < 0,05). Показатели пульса и систолического артериального давления (САД) статистически достоверно повышаются у пациентов с болевым синдромом, в исходные значения показатели гемодинамики приходят в течение 24–48 ч (p < 0,05). Все показатели температуры, боли и гемодинамики представлены в табл. 2.
Таблица 2
Основные показатели гемодинамики, температуры и боли
|
Показатель |
Исходное значение |
Показатели в первые 24 ч после ХП |
Показатели в последующие 24–48 ч после ХП |
|
Пульс |
76 ± 5,8 |
81 ± 6,9 |
75,6 ± 5,7 |
|
САД |
108,3 ± 7,8 |
114,2 ± 7,6 |
108,8 ± 7,8 |
|
Температура тела |
36,6 ± 0,1 |
37,1 ± 0,6 |
36,6 ± 0,1 |
|
Болевая реакция |
0,3 ± 0,5 |
2,2 ± 1,8 |
0,4 ± 0,5 |
Сопоставляя полученные данные с литературными, можно утверждать, что ХП должен применяться после удаления жидкости из брюшной полости. Кроме того, пациентам, которым лапароцентез противопоказан, процедуру ХП можно сочетать с положительным давлением в дыхательных путях, что уменьшает отрицательное давление в плевральной полости и предотвращает перемещение асцитической жидкости [15].
Выводы
1. У пациентов с ЦП при наличии рефрактерного асцита и ПГ возможно применение ХП йодповидоном, что является доступным и эффективным методом лечения.
2. ХП, при котором плевросклерозантом является йодповидон, вызывает минимальные побочные эффекты, связанные с индукцией воспаления, которые нивелируются в течение 24–48 ч.
3. Обязательным условием проведения ХП у пациентов с асцитом является лапароцентез, в противном случае процедура будет безуспешна.
 science-review.ru
science-review.ru