Сахарный диабет является острейшей медико-социальной проблемой, относящейся к приоритетам национальных систем здравоохранения практически всех стран мира [1–3]. Проблема диагностики, лечения и профилактики гнойно-некротических процессов нижних конечностей у больных сахарным диабетом на протяжении многих десятилетий привлекает пристальное внимание хирургов [3, 4]. Поражения стоп в перечне осложнений сахарного диабета занимают лидирующее положение наряду с патологией сердца, почек, органов зрения и в настоящее время выделены в отдельную нозологическую форму – «диабетическая стопа» [3–5].
Установлено, что почти 25 % больных сахарным диабетом страдают синдромом диабетической стопы [1]. Гнойно-некротические процессы нижних конечностей при сахарном диабете приводят к ранней потере трудоспособности и инвалидизации: риск ампутации конечности у больных сахарным диабетом в 20–40 раз выше, чем у человека, не страдающего сахарным диабетом [4, 5]. При глубоком гнойно-некротическом поражении тканей вероятность выполнения высокой ампутации достигает 30–70 % [2, 3]. При этом летальность колеблется от 28 до 40 %, а в последующие 5 лет выживает только 25–40 % больных [1, 3].
Среди наблюдаемых при сахарном диабете тяжелых нейротрофических расстройств важное место занимает диабетическая остеоартропатия. Диабетическая остеоартропатия, частота которой варьирует от 23 % до 78 % [6, 7], считается одним из проявлений сахарного диабета. Поражения костной системы дистальных отделов нижних конечностей являются еще одним тяжелым осложнением сахарного диабета. Многочисленными исследованиями в данной области установлено, что в 90 % случаев костно-суставные изменения при сахарном диабете локализуются в плюсневых и предплюсневых костях, в 10 % – в голеностопных суставах и в суставах больших пальцев стоп [5, 8]. В то же время авторы описывают различной выраженности системный остеопороз у больных сахарным диабетом. Нередко диабетическая остеоартропатия сопровождается возникновением трофических изменений мягких тканей (свищи, язвы и др.). В 55 % случаев осложнением диабетической остеоартропатии является глубокая язва подошвы «Mal perforent», которая в конечном счете приводит к ампутации нижней конечности, последующей инвалидизации и послеампутационной летальности больных сахарным диабетом [9, 10].
Цель работы – провести сравнительную клиническую оценку у больных с диабетической остеоартропатией нижних конечностей.
Материалы и методы исследования
Для решения поставленных в работе задач на базе Национального хирургического центра Министерства здравоохранения Кыргызской Республики проведено обследование и оперативное лечение 136 больных СД в возрасте от 19 до 76 лет, из них 53 мужчин (38,97 %) и 83 женщины (61,03 %) в возрасте от 19 до 76 лет. В связи с чем для решения задач исследования пациенты были разделены на две группы. Основными критериями для разделения обследованных больных было наличие (группа диабетической остеоартропатии (ДОАП+)) или отсутствие (группа синдрома диабетической стопы нейропатической формы (СДС НФ)) остеоартропатии нижних конечностей.
Критериями для постановки клинического диагноза ДОАП были клинические признаки, показатели денситометрии и выявление асептической деструкции костно-суставных структур стопы в типичных местах биомеханического нагружения, которые подтверждены лучевыми методами диагностики – стандартной рентгенографией. В группу ДОАП+ включены 105 (76,9 %) больных. Они соответственно были разделены на две подгруппы. Основными критериями были наличие (подгруппа диабетической гнойной остеоартропатии (ДГОАП), 84 больных) или отсутствие гнойно-некротических осложнений нижних конечностей (подгруппа «ДОАП-», 21 больной).
Также в следующую группу синдрома диабетической стопы нейропатической формы (СДС НФ) включен 31 больной сахарным диабетом, синдромом диабетической стопы I–IV степени, нейропатической формой (без клинических и рентгенологических признаков ДОАП). Отметим, что больные этой группы имели клинические признаки выраженной полинейропатии при отсутствии какой-либо гемодинамически значимой патологии периферического магистрального кровотока (плече-лодыжечный индекс (ЛПИ) ≥ 0,9; РI ≥ 5,5; RI = 0,9–1,0). Распределение больных по полу и возрасту показано в табл. 1.
Таблица 1
Распределение больных СД по полу и возрасту
|
Возраст (лет) |
ДОАП+ |
СДС НФ |
||||||
|
М |
Ж |
М |
Ж |
|||||
|
Абс. ч. |
% |
Абс. ч. |
% |
Абс. ч. |
% |
Абс. ч. |
% |
|
|
19–29 |
5 |
4,8 |
17 |
16,5 |
0 |
0 |
1 |
10 |
|
30–39 |
8 |
7,7 |
7 |
6,8 |
1 |
10 |
0 |
0 |
|
40–49 |
8 |
7,7 |
15 |
14,6 |
1 |
10 |
0 |
0 |
|
50–59 |
7 |
6,7 |
11 |
10,7 |
1 |
10 |
1 |
10 |
|
60–69 |
9 |
8,7 |
12 |
11,7 |
2 |
10 |
2 |
20 |
|
> 70 |
1 |
0,9 |
3 |
2,9 |
0 |
0 |
1 |
10 |
|
Всего |
38 |
36,9 |
67 |
62,6 |
15 |
50 |
16 |
50 |
Результаты исследования и их обсуждение
Как видим из таблицы, преобладающую часть обследуемых больных составили лица женского пола (62,6 %). Отметим, что больные с ДОАП+ выявлялись более в молодом возрасте (45,57 ± 1,41 лет), относительно больных с СДС НФ (без ДОАП) (54,12 ± 2,45 лет), где они встречались у больных старшей возрастной категории [5].
Из табл. 2 мы можем увидеть распределение больных по длительности заболевания и типу сахарного диабета.
Таблица 2
Распределение больных по длительности и типу сахарного диабета
|
Длительность СД (годы) |
Тип сахарного диабета |
|||||||
|
ДОАП+ |
СДС НФ |
|||||||
|
СД 1 тип |
СД 2 тип |
СД 1 тип |
СД 2 тип |
|||||
|
Абс. ч. |
% |
Абс. ч. |
% |
Абс. ч. |
% |
Абс. ч. |
% |
|
|
2–4 |
0 |
0 |
11 |
12,5 |
0 |
0 |
3 |
15 |
|
5–9 |
0 |
0 |
23 |
26,13 |
0 |
0 |
9 |
45 |
|
10–19 |
2 |
11,77 |
41 |
46,6 |
4 |
36,36 |
6 |
30 |
|
20–29 |
10 |
58,82 |
13 |
14,77 |
6 |
54,54 |
2 |
10 |
|
30–39 |
4 |
23,53 |
0 |
0 |
1 |
9,10 |
0 |
0 |
|
> 40 |
1 |
5,88 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Всего |
17 |
100 |
88 |
100 |
11 |
100 |
20 |
100 |
При этом, как видно из табл. 2, в группе больных с ДОАП+ удельный вес с СД 2 типа был достоверно выше, чем у больных с СД 1 типа. У подавляющего большинства больных с ДГОАП и СДС НФ длительность заболевания составила больше 10 лет, 61,37 и 61,3 % соответственно.
При визуальном осмотре стопы выявляли присутствие у 97 (92,4 %) пациентов из группы ДОАП+ и у 22 (70,1 %, p < 0,05) больных из СДС НФ характерные признаки вегетативно-трофических расстройств: сухость, огрубелость, шелушение кожных покровов, атрофические пигментные пятна, участки гиперкератоза в местах повышенного давления на стопе, потертостей, трещин. Отметим, что деформации пальцев стопы по типу когтеобразных выявлены у 85 (81,0 %) пациентов в группе ДГОАП и только у 9 больных (29,03 %, p < 0.05) в СДС НФ, Hallix valgus у 75 (71,4 %) и 11 (35,5 %, p < 0,05) больных соответственно [5].
При офтальмологическом обследовании выявлены у 129 (94,9 %) находящихся под наблюдением пациентов СД имеющиеся признаки в различных стадиях диабетической ретинопатии [5].
А в группе больных с ДОАП+ удельный вес с признаками пролиферативной ретинопатии был выше, чем в СДС НФ, где изменения на глазном дне были выявлены не столь выраженными (табл. 3) [5].
Таблица 3
Результаты офтальмологического обследования пациентов СД
|
Группы пациентов |
ДОАП+ |
СДС НФ |
||
|
Абс. число |
% |
Абс.число |
% |
|
|
Непролиферативная ретинопатия |
32 |
31,7 |
16 |
55,2 |
|
Препролиферативная ретинопатия |
20 |
19,8 |
7 |
24,1 |
|
Пролиферативная ретинопатия |
49 |
48,5 |
6 |
20,7 |
|
Всего |
101 |
100 |
29 |
100 |
Катаракта была выявлена у 87 (82,9 %) пациентов с ДОАП+ и у 21 (67,7 %) больных СДС НФ.
Заметим, что, основываясь на результатах лабораторных исследований (исследований скорости клубочковой фильтрации, суточной протеинурии, уровня креатинина), признаки диабетической нефропатии (ДН) вывялены у 125 (91,9 %) больных с СД. У 77 (91,6 %) больных ДГОАП и 27 (87,1 %) пациентов с СДС НФ.
Выявляемость диабетической нефропатии (ДН) II ст. в группах ДГОАП и СДС НФ достоверно не отличалась (67,5 и 62,96 % соответственно), тогда как в группе ДГОАП выявляли более высокий удельный вес ДН III ст. (24,7 %), сравнительно группы с СДС НФ (11,1 %, при р < 0,05) (рисунок).
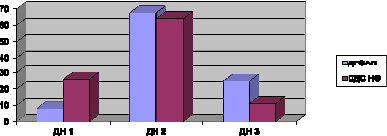
Удельный вес ( %) пациентов с различными стадиями диабетической нефропатии (р < 0,05)
Резюмируя вышеизложенные рассуждения, можно сделать вывод о достоверно высоком удельном весе пациентов с выраженными стадиями диабетической ретинопатии (98,9 %) и нефропатии (92,4 %) в группе больных с ДОАП, относительно больных в группе СДС (25,8 % и 64,5 % соответственно), (р < 0,05) [5].
Отметим, что у 97 (94,1 %) больных с ДОАП+ обнаружены функциональные отклонения желудочно-кишечного тракта, связанные с дискинезией и секреторной дисфункцией кишечника и несвязанные с алиментарным фактором. В семиотике жалобы у 65 (63,1 %) пациентов преобладали запоры. Среди пациентов группы СДС НФ лишь у пяти (16,1 %) были выявлены характерные признаки гастроэнтеропатии.
Корреляционный анализ показал умеренную силу связи между ДОАП+ и поздними осложнениями СД: нефропатией (r = 0,45, р < 0,05), ретинопатией (r = 0.35, p < 0,005) и гастроэнтеропатией (r = 0,83, p < 0,005) [5], что подтверждает их единую патогенетическую основу [11–13].
Отметим, что параллельно с ортопедическими факторами решающим моментом в развитии ДОАП+ может быть ожирение пациента [8, 11]. Усредненные показатели индекса массы тела пациентов (ИМТ) в группе ДГОАП были значительно выше (р < 0,01) 26,21 ± 0,45 кг/м2 показателей у больных группы СДС НФ (25,25 ± 0,39 кг/м2).
Следует подчеркнуть, что все исследуемые больные с гнойно-некротическими осложнениями при ДОАП на период обследования имели клинические и рентгенологические характерные признаков асептического и некротического поражения костно-суставных структур стопы. При распределении больных по выраженности и степени поражения в наших исследованиях применяли классификацию Wagner (1989), которая позволила систематизировать клинико-рентгенологические проявления гнойно-некротических осложнений (табл. 4) [5].
Таблица 4
Распределение больных СДС по степени тяжести (Wagner, 1988)
|
Степень тяжести |
ДОАП + (n = 105) |
СДС НФ (n = 31) |
||
|
Абс. число |
% |
Абс. число |
% |
|
|
0 степень |
21 |
20,8 |
0 |
0 |
|
1 степень |
7 |
6,7 |
2 |
6,5 |
|
2 степень |
11 |
10,5 |
9 |
29,0 |
|
3 степень |
57 |
54,3 |
16 |
51,6 |
|
4 степень |
9 |
8,6 |
4 |
12,9 |
|
5 степень |
0 |
0 |
0 |
0 |
|
Всего |
105 |
100 |
31 |
100 |
Хирургические вмешательства у больных с СДС проводились, учитывая тяжесть состояния больного, объем гнойно-некротического процесса (табл. 5).
Таблица 5
Структура хирургических вмешательств у больных с СДС
|
Оперативные вмешательства |
ДГОАП |
СДС НФ |
||
|
Абс. число |
% |
Абс. число |
% |
|
|
Некротомия, некрэктомия |
104 |
51,7 |
41 |
58,6 |
|
Вскрытие флегмоны |
17 |
8,5 |
9 |
12,9 |
|
Вскрытие абсцесса |
21 |
10,4 |
13 |
18,6 |
|
Секвестрэктомия костей стопы |
37 |
18,4 |
0 |
0 |
|
Ампутация I пальца |
2 |
1,0 |
2 |
2,9 |
|
Ампутация V пальца |
2 |
1,0 |
3 |
4,3 |
|
Ампутация блока, состоявшего из двух или трех пальцев стопы |
2 |
1,0 |
3 |
4,3 |
|
Экзартикуляция I пальца |
3 |
1,5 |
||
|
Экзартикуляция V пальца |
2 |
1,0 |
||
|
Экзартикуляция блока, состоявшего из двух или трех пальцев стопы |
2 |
1,0 |
||
|
Трансметатарзальная ампутация стопы |
2 |
1,0 |
3 |
4,3 |
|
Ампутация на уровне голени |
2 |
1,0 |
0 |
0 |
|
Ампутация на уровне бедра |
3 |
1,5 |
1 |
1,4 |
|
Артродез голеностопного сустава |
2 |
1,0 |
0 |
0 |
|
Всего |
201 |
100 |
70 |
100 |
В обеих исследуемых группах больных с ДГОАП и СДС НФ большая часть хирургических манипуляций и операций пришлась на малые оперативные вмешательства (некротомии – 51,7 % и некрэктомии – 58,6 %). В группе больных с ДГОАП секвестрэктомия составила 18,4 % от общего числа и объема хирургических вмешательств. При этом секвестрэктомия в группе больных СДС НФ не производилась, что объясняется особенностью ДОАП нижних конечностей [5].
Заключение
Сравнительный анализ показал, что у пациентов группы ДГОАП и СДС НФ по клиническим показателям были выявлены статистически значимые различия по таким параметрам, как возраст, тип и длительность заболевания СД, уровень компенсации углеводного обмена. Удельный вес пациентов с выраженными микрососудистыми осложнениями СД (ретино- и нефропатия) был также достоверно выше в группе ДГОАП. По характеру оперативных вмешательств у пациентов с ДГОАП и СДС НФ на стопах производились преимущественно малые операции (некрэктомии, некротомии и вскрытие гнойников) [5].
 science-review.ru
science-review.ru