Пищевая аллергия (ПА) в настоящее время остается серьезной проблемой здоровья детей как всемирного, так и всероссийского здравоохранения. Согласно клиническим рекомендациям, ПА – вызванная приемом пищевого продукта патологическая реакция, в основе которой лежат иммунные механизмы: специфические IgE опосредованные реакции, клеточный иммунный ответ (не IgE-опосредованные) или их сочетание – реакции смешанного типа [1]. В подавляющем большинстве случаев причинно-значимыми аллергенами при ПА являются белки пищевых продуктов, наиболее часто вызывают ПА коровье молоко, куриное яйцо, арахис, орехи, рыба, морепродукты, пшеница и соя. Гастроинтестинальная форма ПА наиболее характерна для детей первых лет жизни, одной из ее клинических проявлений является аллергическая энтеропатия (индуцированная пищей энтеропатия) [1].
Эпителий кишечника представляет собой самую большую слизистую оболочку в организме человека, постоянно контактирующую с внешней средой. Основной функцией эпителиального барьера ЖКТ является защита от проникновения чужеродных антигенов, микробов и вырабатываемых ими токсинов, в то же время он должен участвовать в выполнении всасывания основных питательных веществ, воды и электролитов [2]. В настоящее время проводятся исследования по изучению патогенетической связи между формированием пищевой аллергии и дефектами барьерной функции кишечника.
Рядом исследований было продемонстрировано, что возникновение ПА, в том числе аллергической энтеропатии, у детей первого года жизни связано с недостаточностью барьерной функции желудочно-кишечного тракта по отношению к экзогенным аллергенам, что обусловлено его анатомо-физиологическими особенностями. Для данного возрастного периода особенно характерна морфофункциональная незрелость эпителиальных клеток слизистой оболочки тонкой кишки [3].
Характерными проявлениями острой аллергической энтеропатии являются рвота, длительная диарея, отставание в росте, недостаточный набор массы тела, при длительном течении – явления белково-энергетической недостаточности. Отличительным признаком энтеропатии является поражение ворсинок и формирование связанного с этим синдрома мальабсорбции [1].
Несвоевременная диагностика и отсутствие адекватного лечения аллергической энтеропатии способствуют развитию хронической неинфекционной патологии ЖКТ, с нарушением процессов пристеночного и полостного пищеварения [2]. В связи с этим очевидна актуальность проблемы мониторинга клинических проявлений, разработка методов объективной оценки тяжести проявлений со стороны органов ЖКТ для своевременного уточнения стадии течения заболевания. Это поможет подобрать адекватную тактику ведения пациента, своевременно проводить коррекцию на этапах элиминационной диетотерапии.
Для педиатрической практики, особенно у детей первого года жизни, наиболее важна разработка методов неинвазивного мониторинга состояния систем организма и их функциональной активности.
В настоящее время изучается роль фекального кальпротектина (ФК) как неинвазивного маркера гастроинтестинальных заболеваний [3]. Повышенные уровни кальпротектина были описаны как у взрослых, так и у детей с воспалительными заболеваниями кишечника и используются для оценки тяжести воспаления у этих пациентов [4, 5]. Было обнаружено, что уровни кальпротектина в фекалиях могут указывать на аллергию на коровье молоко и атопические заболевания, а также на желудочно-кишечные расстройства [6, 7]. Диагностическая ценность кальпротектина у детей раннего возраста также вызывает растущий интерес. Повышенные концентрации кальпротектина в кале коррелируют с тяжестью воспалительных процессов при воспалительных заболеваниях кишечника [8, 9], но могут встречаться и у здоровых новорожденных [10]. До настоящего времени существуют противоречивые данные о референсных значениях данного маркера у детей первого года жизни, не определена его роль у детей первого года с аллергической энтеропатией [11, 12].
Цель исследования – изучить возможность использования неинвазивных методов оценки состояния кишечного барьера для мониторинга детей первого года жизни с аллергической энтеропатией
Материалы и методы исследования
Проведено клинико-лабораторное обследование 20 детей с аллергической энтеропатией, пищевой аллергией к белкам коровьего молока в возрасте от 1 до 12 месяцев (I группа). Группу контроля (II группа) составили 20 здоровых детей, сопоставимых по полу и возрасту. Всем детям была проведена клиническая оценка тяжести гастроинтестинальных проявлений с помощью разработанной шкалы (табл. 1), которая включала в себя ряд показателей: длительность и интенсивность плача, немотивированное беспокойство в течение суток, объем срыгиваний, характер стула, прибавка в массе тела и аппетит. Каждый показатель оценивался в баллах в зависимости от выраженности проявлений.
Наряду с традиционным обследованием всем детям определяли фекальный кальпротектин с помощью реактивов BÜHLMANN Calprotectin ELISA, фирмы «BSM» (USA) методом сэндвич-варианта твердофазного иммуноферментного анализа ELISA.
Статистическая обработка полученных данных была проведена с использованием пакета программ «Statistica», версия 13.0. Обработка полученного при исследовании материала проводилась по критериям вариационно-статистического анализа. Для результатов количественных данных приводится среднее арифметическое оцениваемого параметра, а также медиана (Ме), минимум и максимум значений, коэффициент корреляции Спирмена, для оценки различий между двумя независимыми выборками определяли критерий Манна – Уитни.
Таблица 1
Шкала оценки гастроинтестинальных симптомов пищевой аллергии к белкам коровьего молока у детей первого года жизни
|
№ |
Симптомы |
Характеристика |
Баллы |
|
1 |
Плач, беспокойство (если ребенок плачет систематически на протяжении более 1 недели без видимой причины, как считают родители) |
≤ 1 часа/день |
0 |
|
1–1,5 часа/день |
1 |
||
|
1,5–2 часа/день |
2 |
||
|
2–3 часа/день |
3 |
||
|
3–4 часа/день |
4 |
||
|
4–5 часов/день |
5 |
||
|
Более 5 часов /день |
6 |
||
|
2 |
Срыгивания |
0–2 эпизода/день |
0 |
|
≥ 3 – ≤ 5 небольшого объема |
1 |
||
|
> 5 эпизодов в объеме > 1 кофейной ложки |
2 |
||
|
> 5 эпизодов в объеме ± половины порции < половины кормлений |
3 |
||
|
Постоянное срыгивание в небольшом объеме в течение > 30 мин после каждого кормления |
4 |
||
|
Срыгивание от половины до всего объема порции питания во время по меньшей мере половины кормлений |
5 |
||
|
Срыгивание всей порции питания после каждого кормления |
6 |
||
|
3 |
Характер стула 1 |
Тип 1 – в форме ореха, отдельные твердые комки |
4 |
|
Тип 2 – в форме комковатой колбаски |
4 |
||
|
Тип 3 – в форме колбаски с ребристой поверхностью |
1 |
||
|
Тип 4 – в форме гладкой колбаски, змейки, мягкий |
0 |
||
|
Тип 5 – маленькие мягкие шарики с ровными краями |
0 |
||
|
Тип 6 – кашицеобразный стул |
0 |
||
|
Тип 7 – водянистый без твердых частиц |
6 |
||
|
4 |
Характер стула 2 |
Патологические примеси отсутствуют |
0 |
|
Наличие патологических примесей (слизь, непереваренные комочки и т.п.) в копрограмме |
1 |
||
|
Наличие примеси слизи в кале при визуальном осмотре |
2 |
||
|
Слизь в кале обильна при визуальном осмотре |
4 |
||
|
Наличие примеси крови в кале при визуальном осмотре |
6 |
||
|
5 |
Прибавки в массе тела за декретированный период |
Прибавка в массе тела соответствует норме |
0 |
|
Прибавка в массе тела недостаточная |
2 |
||
|
Прибавка в массе тела отсутствует |
4 |
||
|
Потеря в массе тела |
6 |
||
|
6 |
Аппетит |
Аппетит хороший |
0 |
|
Отмечается снижение/отсутствие аппетита |
3 |
||
|
Итого: |
|||
Результаты исследования и их обсуждение
Характерными симптомами аллергической энтеропатии у детей первого года жизни в нашем исследовании являлись: срыгивания у 8 детей (40 %), неустойчивый характер стула у 20 детей (100 %), наличие патологических примесей в кале 18 детей (90 %), колики у 13 детей (65 %), флатуленции у 9 детей (45 %), недостаточные прибавки в массе у 12 детей (60 %). Клинические проявления аллергической энтеропатии характеризуются своим разнообразием и неспецифичностью, что согласуется с данными литературы [2]. Недостаточная, часто субъективная оценка симптомов со стороны желудочно-кишечного тракта (ЖКТ) приводит к поздней постановке диагноза, необоснованным ограничениям в еде, неадекватно назначенной терапии, а зачастую и полипрагмазии, что ложится тяжелым бременем на финансовое состояние родителей. Для адекватного ведения пациентов и своевременной коррекции терапии необходимость использования в практике объективных методов оценки данных проявлений не вызывает сомнения.
У всех детей была проведена оценка тяжести гастроинтестинальных проявлений с помощью разработанной шкалы (табл. 1). Каждый показатель оценивался в баллах в зависимости от выраженности проявлений. В результате проведенного исследования было установлено, что у детей I группы ТГП составила 15 баллов (Ме = 15, Q1 = 11, Q3 = 18). У детей контрольной группы ТГП – 4 балла (Me = 4, Q1 = 2, Q3 = 4, p < 0,05, рис. 1)
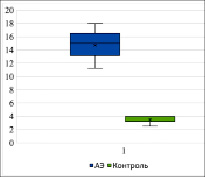
Рис. 1. Оценка тяжести гастроинтестинальных проявлений, баллы (p < 0,05)
Разработанная шкала оценки тяжести гастроинтестинальных проявлений позволяет объективно оценить выраженность клинических проявлений, ее работоспособность была продемонстрирована в нашем исследовании, использование динамической оценки состояния ребенка позволяет своевременно судить об эффективности проводимых мероприятий и своевременно проводить коррекцию терапии.
Маркер состояния кишечного барьера фекальный кальпротектин в течение нескольких лет является маркером воспалительных заболеваний кишечника, существуют неопровержимые данные о его участии при аллергическом поражении кишечника, но в современной литературе данные о его содержании у детей первого года противоречивы, информации о динамике его изменения у детей с аллергической энтеропатией недостаточна. Уровень фекального кальпротектина в нашем исследовании был статистически значимо выше у детей с ПА (I группа) и составил 331 мкг/г (Me = 331, Q1 = 234, Q3 = 350) и 59 мкг/г (Me = 59, Q1 = 52, Q3 = 71) у детей I и II групп соответственно, p < 0,05, данные приведены на рис. 2.
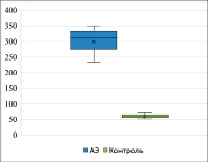
Рис. 2. Уровень фекального кальпротектина, мкг/г (p < 0,05)
Авторами были изучены показатели фекального кальпротектина и показатели балльной оценки тяжести гастроинтестинальных проявлений у детей с аллергической энтеропатией в зависимости от возраста (табл. 2). В нашем исследовании не было выявлено достоверных различий определяемых показателей в различных возрастных группах.
Для оценки выраженности связи между исследованными показателями и тяжестью проявлений по шкале ТГП был рассчитан коэффициент ранговой корреляции Спирмена, выявлены умеренные корреляционные взаимосвязи средней интенсивности (r = 0,617 и r = 0,675 соответственно, p < 0,05).
Кальпротектин, димер кальцийсвязывающих белков S100A8 и S100A9, составляет основной компонент белкового состава нейтрофилов (до 60 %) и оказывает бактериостатическое и фунгистатическое действие. ФК также конститутивно экспрессируется моноцитами, дендритными клетками, активированными макрофагами, оральными кератиноцитами и эпителием слизистой оболочки [5].
Таблица 2
Фекальный кальпротектин и показатели тяжести гастроинтестинальных проявлений у детей с аллергической энтеропатией в зависимости от возраста
|
Возраст |
ФК (мкг/г) |
ОТГП (баллы) |
||||
|
Me |
Q1 |
Q3 |
Me |
Q1 |
Q3 |
|
|
1–3 месяцев (n = 8) |
250 |
208 |
336 |
15 |
12 |
16 |
|
4–6 месяцев (n = 5) |
240 |
192 |
317 |
16 |
12 |
18 |
|
7–9 месяцев (n = 4) |
324 |
295,5 |
357 |
14 |
||
|
10–12 месяцев (n = 8) |
329 |
300 |
340 |
15 |
11 |
18 |
Примечание: * U-критерий Манна – Уитни 22,5, критич. значение 5 (статистически не значимы); ** U-критерий Манна – Уитни 16, критич. значение 5 (статистически не значимы)
Доказано, что его экспрессия может индуцироваться специфически во время аллергического воспаления. В нашем исследовании фекальный кальпротектин у детей с аллергической энтеропатией превышал показатели контрольной группы более чем в 5 раз. Это согласуется с данными проведенных ранее исследований [7, 8] и подтверждает, что фекальный кальпротектин может служить достоверным маркером, позволяющим судить о выраженности воспалительного повреждения слизистой оболочки кишечника, в том числе аллергического генеза. При анализе определяемых показателей у детей с аллергической энтеропатией в различных возрастных группах мы не обнаружили статистически значимых различий, что косвенно подтверждает активное участие данного маркера именно в воспалительных изменениях кишечника и не может быть объяснено функциональной незрелостью детей данной возрастной группы. Необходимо проводить более масштабные исследования для изучения возрастных норм данного маркера у здоровых детей.
Заключение
Таким образом, фекальный кальпротектин у детей с гастроинтестинальными проявлениями пищевой аллергии является объективным и достоверным маркером состояния кишечного барьера. Его уровень прямо зависит от тяжести гастроинтестинальных проявлений. Для оценки тяжести гастроинтестинальных проявлений можно использовать разработанную шкалу оценки клинико-анамнестических симптомов. Оптимизация диагностики и мониторинга аллергической энтеропатии с помощью данных методов может использоваться как в острый период, так и на этапах мониторинга заболевания.
 science-review.ru
science-review.ru