Введение
Важность выбора подходящего подхода к лечению ран различной тяжести, особенно в условиях инфицирования бактериями инфекций не уменьшилась, а фактически стала еще более критичной. Растущее количество пациентов, страдающих от ран различного происхождения, включая пострадавших в результате несчастных случаев, стихийных бедствий и военных конфликтов, подчеркивает настоятельную необходимость поиска новых подходов к эффективной терапии. Более того, расширение масштабов хирургических вмешательств и рост заболеваемости бактериальными инфекциями после медицинских процедур также указывает на необходимость такого поиска. К сожалению, развитие устойчивости к антибиотикам представляет собой серьезную преграду в решении этой проблемы, поскольку это ограничивает эффективность традиционных методов лечения и требует создания новых терапевтических стратегий. Чтобы преодолеть эти проблемы, исследователи должны сосредоточиться на разработке инновационных решений, которые могут эффективно бороться с бактериальными инфекциями, сводя к минимуму риск развития резистентности [1, 2].
Разработка и внедрение в клиническую практику новых лекарственных препаратов является сложным и длительным процессом, требующим многочисленных экспериментов, в том числе на животных моделях. Существует высокая потребность в создании надежных моделей ран, позволяющих исследовать процесс их заживления в ходе доклинических испытаний новых терапевтических средств. Такие модели должны быть технологически продвинутыми, легко воспроизводимыми и стандартизированными для разных видов экспериментальных животных. Эти модели дают возможность глубже понять процессы заживления ран и оценить влияние системных и местных факторов, фармакологических средств и физических воздействий [2].
Преимущественно, в качестве экспериментальных животных для изучения заживления ран хорошо подходят грызуны, поскольку они доступны по стоимости и с ними легко работать. Раны у таких животных заживают несколько иначе, чем у человека, в первую очередь из-за иного процесса сокращения (стягивание краев раны), из-за более обширного подкожно-поперечно-полосатого мышечного слоя, называемого panniculus carnosus, который в значительной степени оказывает влияние на регенерацию мягких тканей. Тогда как у человека основой процесса заживления раны является реэпителизация и образование грануляционной ткани [3–5]. Тем не менее экспериментальное моделирование позволяет решить проблему доклинического испытания новых лекарственных средств и терапевтических подходов для ускорения процесса регенерации мягких тканей.
Цель исследования – провести анализ данных современной литературы, представляющих различные способы моделирования раневого процесса на лабораторных животных.
Материалы и методы исследования
В рамках исследования был проведен анализ последних данных о роли компонентов иммунной системы и стволовых клеток в восстановлении мягких тканей. Данные были собраны из различных научных источников, таких как Google Scholar, Medline, PubMed и eLibrary. Дополнительно были изучены патенты и научные разработки, посвященные методикам моделирования раневого процесса. Временной диапазон поиска охватывал последние 17 лет, что позволило включить наиболее значимые и актуальные данные, отражающие современные тенденции в изучении заживления ран.
В ходе анализа изначально было отобрано 30 работ, из которых 12 были включены в финальный обзор на основании их соответствия исследуемой теме и качества представленных данных. При подготовке обзора использовались современные принципы систематизации и анализа информации в соответствии с рекомендациями PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses), что обеспечивает стандартизацию и прозрачность методов исследования [6].
Результаты исследования и их обсуждение
Острая рана представляет собой неожиданное повреждение кожи, которое обычно заживает без осложнений и в ожидаемые сроки, восстанавливая при этом анатомическую и функциональную целостность тканей. В зависимости от механизма травмы, раны могут быть классифицированы как резаные, ушибленные, рваные, колотые, разрывные или ожоговые. В процессе экспериментального моделирования ран важно учитывать скорость их заживления, которая зависит от вида лабораторного животного, а также целей и задач исследования. Использование крупных животных позволяет создавать множественные раны на одной особи, что облегчает проведение обширных исследований. Среди наиболее распространенных моделей для воспроизведения острых ран у животных выделяются резаные (инцизионная), эксцизионные и ожоговые модели [7].
Модель резаной раны на животных применяется для изучения новых методов лечения для оценки скорости заживления и образования рубца. Эта модель широко используется для оценки новых методов лечения, анализа скорости заживления и формирования рубцовой ткани. Как правило, в этой модели раны наносятся с помощью скальпеля или острых ножниц на спине животного, параллельно средней линии тела. Разрез затрагивает эпидермис, дерму и подкожную клетчатку, иногда доходя до мышц. В некоторых случаях применяется электрокоагуляция или лазер, хотя электрокоагуляция может вызывать термическое разрушение тканей, что отличает такие раны от полученных с помощью острых инструментов. Модели первичного заживления включают соединение краев раны с помощью швов, скоб или клипс, что способствует формированию грануляционной ткани и эпителия. Вторичное заживление более предпочтительно для изучения долгосрочного рубцевания, так как рана остается открытой, что ведет к формированию фибринового сгустка, который затем замещается грануляционной тканью, сопровождаясь эпителизацией и сокращением раны [7].
Моделирование линейной раны. Линейные раны наносятся при соблюдении асептических условий и могут сопровождаться вживлением шовного материала для исследования процесса заживления. Недостатки данного способа заключаются в возможности моделирования небольших асептических линейных ран, неосложненных гнойно-воспалительным процессом при неконтролируемой площади в результате отсутствия фиксации их краев, поэтому этот способ не универсален и без возможности создания условий, приближенных к реальности [2].
Модель линейной раны. Для выполнения модели линейной раны животное фиксируют под общей анестезией. В области лопаток на спине подготавливают операционное поле размером 6,0×4,0 см: кожу бреют, а затем обрабатывают антисептиками – трехкратно 5 % раствором йода и однократно 3 % раствором хлоргексидина биглюконата. Линейный разрез длиной 1,0–1,5 см выполняется по паравертебральной линии скальпелем, затрагивая кожу, подкожную жировую клетчатку, поверхностную фасцию и мышечную ткань [2].
Модель раны с иссечением кожи и раздавливанием ее краев. Для создания этой модели на предварительно депилированной коже бедренно-ягодичной области животного с использованием картонного шаблона маркером наносят контур будущей раны диаметром 2,5 см. Кожу обрабатывают антисептическим раствором «Инол» дважды, после чего выполняется местная анестезия 0,5 % раствором новокаина. Через 7–10 минут скальпелем производится иссечение кожи и подкожной клетчатки до поверхностной фасции. Затем края раны раздавливаются с помощью зажима Кохера, после чего в нее вводится 2 мл взвеси бактерий, содержащей 109 микробных тел на 1 мл, которые были выращены на агаре в течение 24 ч. После этого, для герметизации, предотвращения травмирования раны и ее обсеменения микроорганизмами, к краям подшивается обвивным непрерывным швом капроновой нитью пластмассовое кольцо с высотой бортика 1,2 см и диаметром 2,5 см с крышкой, в которое вставляется сухой стерильный марлевый шарик. Для предотвращения перегрызания лигатур и нанесения дополнительных травм друг другу крысы должны находиться в индивидуальных клетках при свободном доступе к пище и воде [1, 8].
Модель раны с удалением кожи и подлежащей жировой клетчатки. У крыс под анестезией (ингаляция изофлурана) на спине, ближе к голове, на уровне лопаток подготавливают операционное поле, для чего удаляют шерсть, обрабатывают кожным антисептиком и подсушивают стерильной салфеткой. Затем с использованием трафарета и хирургического маркера наносится контур раны диаметром 2 см и с помощью ножниц удаляется участок кожи с подлежащей жировой клетчаткой. Рана покрывается сухой стерильной марлевой салфеткой, прокладывается слоем полиэтиленовой пленки и фиксируется бинтом на 48 ч, после чего повязка снимается и до конца периода наблюдения остается открытой [9].
Модель хронических кожных ран. Для создания модели хронических кожных ран применяется устройство, представляющее собой плоское полимерное кольцо, оборудованное фиксирующими элементами, изготовленными из нерассасывающихся шелковых лигатур. Эти лигатуры проходят через отверстия кольца с осями, параллельными его оси, которые расположены равномерно по окружности и равноудалены от его наружной и внутренней стенок. Данное устройство в условиях экспериментальной лаборатории позволяет моделировать длительно не заживающие раны кожи у резистентных животных с устойчивой регенерацией кожных покровов при длительном сроке полной эпителизации. Такая модель необходима для исследования механизмов хронического воспаления и изучения репаративных процессов в тканях, она дает возможность для изучения кинетических, патоморфологических, микробиологических и биохимических процессов. Кроме того, она может быть использована для изучения влияния лекарственных и физиотерапевтических средств, ускоряющих репаративные процессы в коже. Данная модель также позволяет оценить эффективность перевязочного материала, трансплантатов и других медицинских изделий, которые могут использоваться для ускорения процессов регенерации тканей [10].
Модель ран с циркулярным и двумя параллельными разрезами. Для формирования модели с циркулярным и двумя параллельными разрезами, лабораторному животному, в данном случае мыши, под общей анестезией тщательно удаляют шерсть в межлопаточной области, затем по центру спины иссекают полнослойное циркулярное отверстие диаметром 5–7 мм, после чего наносят два параллельных разреза, симметрично расположенных относительно круглого отверстия и идущих от шейного отдела к нижней части спины. Длина разрезов составляет 30 мм, расстояние между ними 10 мм. Участок кожи между разрезами отделяют от подкожной фасции и сосудов, кровоснабжающих полученный лоскут с краниальной и каудальной сторон, а также располагающихся латерально относительно лоскута. Для фиксации краев кожного лоскута и придания ему устойчивой структуры лоскут подворачивают внутрь раны, а края закрепляют шестью хирургическими швами с каждой стороны. Таким образом, получается Н-образный ишемизированный кожный лоскут с круглой раной по центру. Преимуществом данного способа является создание длительно не заживающей раны, которая не содержит удерживающих конструкций (колец), что приближает предложенную модель к человеческой кожной ране [11].
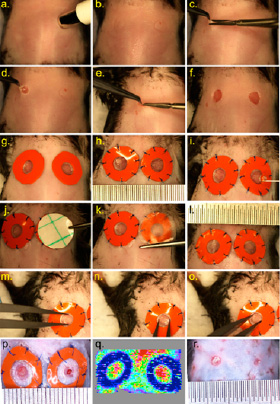
Операция по заживлению ран и послеоперационные измерения:
После удаления волос и подготовки кожи йодом и спиртом (a–b), с помощью биопсийного перфоратора аккуратно очерчивают два круга на тыльной стороне, по обе стороны от средней линии. (c) Затем делается небольшой разрез и (d) удаляется круглый кусочек кожи, (e) включая карнозную мышцу, (f) для создания двух глубоких ран. (g) Затем на силиконовые шины наносится клей, и шины приклеиваются к периметру раны. (h) Затем шины закрепляются швами. (i) Лечение проводится местно, и (j–k) на рану накладывается окклюзионная прозрачная повязка и приклеивается к шинам (при необходимости можно использовать клей). (l) Ежедневно делаются микрофотографии, и площадь раны рассчитывается по среднему значению трех измерений диаметра по осям (m) y, (n) x и (o) z. (p) Репрезентативная фотография ран на 10-й день, отмечающая меньшую рану справа, которая была обработана терапевтическим составом. (q) Репрезентативное лазерное доплеровское изображение кровоснабжения раны на 6-й день. (r) пример быстрого сужения раны после снятия силиконовых шин [5]
Модель раны с использованием силиконовой шины. Животным вызывается общая анестезия с использованием 5 % изофлурана в 100 % растворе кислорода (скорость потока 1 л/мин) при поддерживающей 1–3 % изофлураном. Затем подготавливается операционное поле путем удаления шерсти и протирания кожи спиртовым тампоном, затем наносятся два слоя 10 % повидон-йода (бетадина). Стерильным 4-миллиметровым биопсийным перфоратором очерчиваются два круглых контура раны по обе стороны от средней линии спины мыши на уровне лопаток. Зазубренными щипцами приподнимается кожа в середине контура, и микрохирургическими ножницами наносятся раны с разных сторон от средней линии, включая подкожную клетчатку, carnosus, с иссечением мышечного слоя. Заранее подготовленная силиконовая шина накладывается вокруг двух нанесенных 10-миллиметровых ран на всю толщину биопсии, предотвращая сокращение panniculus carnosus с заживлением по типу эпителизации и ангиогенеза. Две шинированные раны позволяют одномоментно проводить экспериментальное исследование и самостоятельным контролем. Оценка реперфузии крови с использованием лазерной доплерографии показала, что шина одновременно останавливает механизм сокращения заживления и удлиняет процесс заживления хронической раны. Недостатками этой модели являются локальное воспаление, вызывающее разрушение швов, вмешательство самих животных, царапающих или кусающих швы, а также возможность попадания любого местного терапевтического средства, нанесенного на контрольную рану, в систему кровообращения [5, 12].
Заключение
Воспроизведение различных экспериментальных моделей нанесения кожных ран является важным инструментом для оценки эффективности новых лекарственных средств и терапевтических подходов к ускорению регенерации мягких тканей, а также для более глубокого понимания механизмов их заживления и патогенеза. В условиях широкого выбора экспериментальных животных и разнообразных моделей кожных ран исследователь должен заранее определить наиболее подходящий вид животного и метод воспроизведения ран, ориентируясь на цели и задачи эксперимента.
 science-review.ru
science-review.ru