Введение
Сегментарные дефекты длинных трубчатых костей представляют собой сложную патологию, обусловленную множеством причин: несращение переломов, ложные суставы либо резекция объемных опухолевых образований. Утраченный объем костной ткани – это не только фактическое отсутствие участка кости, но также изменения таких ее характеристик, как плотность. Например, уплотнение вследствие импрессионного перелома, требующего реконструктивной коррекции, а также несоответствие структурно-функциональных характеристик костной ткани, в частности, в области ложного сустава [1]. Трудности могут возникать при замещении костных дефектов как ограниченных, так и неограниченных, что имеет особое значение при сочетании патологического процесса с нарушением нормальной биомеханики [2–4].
При лечении больных с дефектами длинных костей конечностей можно выделить такие основные направления, как формирование дистракционного регенерата по Г.А. Илизарову и использование пластических материалов для замещения костных дефектов. Негативные стороны лечения дефектов длинных костей по Г.А. Илизарову становятся наиболее очевидными в случае, если протяженность формируемого регенерата составляет больше 20 % длины сегмента, подвергаемого реконструкции. В процессе дистракционного остеосинтеза в литературе описано более 10 видов специфических осложнений, характерных именно для случаев лечения дефектов костей на уровне плеча и предплечья [5]. При относительно небольших костных дефектах с адекватным покрытием мягких тканей костную щель обычно можно закрыть обычными губчатыми костными трансплантатами. Однако большинство авторов не поддерживают этот метод, когда дефект превышает 4–5 см. Частичная резорбция трансплантата и реваскуляризация путем постепенного замещения приводят к ослаблению реконструированного сегмента, что предрасполагает к повторным переломам. Таким образом, при сегментарных костных дефектах размером более 4–5 см, с дефектом мягких тканей или без него, возникает необходимость в более специализированном лечении [6].
Метод индуцированной мембраны Masquelet (MIMT) – относительно новый двухэтапный подход к реконструкции сегментарных дефектов кости. В 1980-х гг. Masquelet лечил пациентов с инфекцией в месте несращения перелома с помощью радикальной хирургической обработки раны и восстановления мягких тканей с помощью мышечных лоскутов, после чего помещал спейсер из метакрилатного цемента в образовавшиеся дефекты кости. Обоснованием было сохранение длины конечности и соответствующего натяжения мягких тканей. Впоследствии, при отсутствии признаков инфекции, спейсер удалялся, проводилась костная пластика и окончательная фиксация, как завершающий этап лечения.
Помещенный в область дефекта кости цементный спейсер вызывает иммунную реакцию как инородное тело. Новый подход доктора Masquelet заключался в использовании полученной индуцированной мембраны для закрытия аутотрансплантата, который обычно помещался в дефект после удаления стабилизирующего спейсера. Мембрана при этом служит проводником для клеток и обеспечивает благоприятную среду для остеоинтеграции костного трансплантата. Формирование индуцированной мембраны вокруг цементного имплантата является ключевым компонентом реконструктивной хирургии по методу Masquelet для лечения дефектов костной ткани [7, 8]. Исследования на животных показали, что индуцированная мембрана обладает остеоиндуктивной активностью, а также формирует богатую сосудистую сеть [9–11]. Богатая васкуляризация и высокая пролиферативная активность индуцированной мембраны являются важными компонентами для успешной реконструкции кости. Однако данные о свойствах имплантата и гистологических исследованиях образцов индуцированной мембраны человека ограничены [12–14]. Для планирования и успешного проведения второго этапа пластики по Masquelet важно понимать, на каких сроках активность индуцированной мембраны наиболее выражена.
Цель исследования – дать морфологическую и иммуногистохимическую оценку состояния индуцированной мембраны при лечении пациентов с посттравматическими дефектами трубчатых костей на разных сроках проведения костной пластики.
Материалы и методы исследования
В исследование были включены пациенты, проходившие хирургическое лечение в университетской клинике Приволжского исследовательского медицинского университета (ПИМУ) в период с 2020 по 2025 г., которым были устранены дефекты костей с использованием метода Masquelet. Исследование проводилось в соответствии с Хельсинкской декларацией 1964 г. и последующими поправками к ней. Кроме того, исследование предварительно было рассмотрено на заседании локального этического комитета (ЛЭК) ФГБОУ ВО ПИМУ Минздрава России и единогласно одобрено всеми его членами (протокол заседания ЛЭК № 16 от 21.10.2022).
Основную группу составили 12 пациентов с повреждениями на уровне плечевой кости, которым была проведена двухэтапная костная пластика по Masquelet. Распределение пациентов по возрасту – от 25 до 70 лет, распределение по полу – 8 мужчин и 4 женщины. Костные дефекты имели различные размеры в пределах от 2 до 6 см. Пациентам данной группы была произведена двухэтапная костная пластика с фиксацией пластиной LCP и винтами. Трансплантат был забран из гребня подвздошной кости. Периоды проведения второго этапа костной пластики указаны в таблице.
Характер исследования второго этапа операции
|
Время проведения второго этапа относительно первого, недели |
Размер дефекта, см |
Количество пациентов, чел. |
|
3 |
2–4 |
3 |
|
4 |
3–6 |
3 |
|
5 |
2–3 |
3 |
|
6 |
2–4 |
3 |
Во время второй операции (удаление цемента и пересадка костной ткани) были взяты и зафиксированы в растворе нейтрального забуференного формалина (10 %) образцы сформированной индуцированной мембраны (до 0,5 см²) из зон непосредственного контакта с цементным спейсером для последующего исследования в лаборатории патоморфологии (ПИМУ, Университетская клиника). Гистологическую проводку осуществляли на аппарате Excelsior ES, после чего на заливочной станции HistoStar изготавливали парафиновые блоки. На микротоме Microm HM 325 получали срезы толщиной от 4 до 5 мкм. Полученные таким образом препараты окрашивали с применением станции для окраски Gemini AS. Все оборудование – Thermo Scientific, СШA.
В ходе исследования гистологического материала использовали обзорные окраски: гематоксилином и эозином и Ван-Гизон (набор Biovitrum, Россия). Применили иммуногистохимическое исследование неоангиогенеза биологической мембраны с применением первичных антител к CD31 (PECAM-1, мышиное антитело, clon GM006, ПраймБиоМед, Россия), иммуногистохимическое исследование пролиферативной активности мембраны с применением первичного антитела к Ki-67 (мышиное антитело, clon MIB-1, Dako, USA), выявление матриксной металлопептидазы 9 (мышиное антитело, clon 5G3, Thermo Scientific, СШA). В качестве вторичного антитела было использовано MACH 2 Double Stain 2 (Biocare Medical, USA), который включает конъюгат goat anti-mouse polymer horseradish peroxidase (HRP). Сигнал регистрировали по реакции с диаминобензидином (ДАБ) в течение 10 мин. Срезы контрастировали гематоксилином. Подсчет пролиферативной активности клеток проводили путем определения среднего количества Ki-67 позитивных клеток в 10 полях зрения при увеличении Х400. Оценку активности неоангиогенеза определяли по количеству новообразованных сосудов при окраске гематоксилином и эозином, а также по среднему количеству CD31 позитивных сосудов в 10 полях зрения при увеличении Х400. Подсчет соединительнотканных волокон выполнили измерением относительной площади окрашенных коллагеновых волокон фуксином по методу Ван-Гизон [15].
Статистическая обработка полученных результатов была реализована с применением подходов программного обеспечения Stаtistiсa 10.0 (StatSoft Inc., США). Числовые значения исследуемых показателей не удовлетворяли условиям параметрического тестирования, в связи с чем при анализе данных были использованы непараметрические критерии. Результаты представлены в виде значений медиан. В квадратных скобках указаны значения нижнего и верхнего квартилей для каждого срока исследования. Сравнение данных между группами было проведено с применением множественного непараметрического критерия несвязанных групп. Оценка наличия статистически значимых различий между группами осуществлялась путем их попарного сравнения с использованием U-критерия Манна – Уитни, при значении p ≤ 0,05 отличия между группами статистически значимы.
Результаты исследования и их обсуждение
При гистологическом исследовании экспериментального материала образцов мембраны установлено, что она состояла из васкуляризированного матрикса на основе коллагена. Однако, в зависимости от сроков созревания мембраны, интенсивность ее васкуляризации либо развития соединительной ткани различались. На 2-й неделе после начала эксперимента новообразованная мембрана была представлена тканевым матриксом с присутствием коллагеновых волокон и небольшим количеством сосудов. На 4-й неделе преобладали новообразованные сосуды, на 6-й – в сформированной, хорошо васкуляризированной мембране преобладали соединительнотканные волокна. Полуколичественная оценка соединительнотканных волокон проводилась с использованием специальной окраски Ван-Гизон с применением пикрофуксина.
Было установлено, что площадь соединительнотканных волокон (рис. 1, С) составила 10 [6,4; 14,3] % на 3-й неделе проведения второго этапа операции, в то время как на 4-й неделе этот параметр увеличился и площадь соединительной ткани составила уже 15 [11,7; 20,3] %. На 5-й неделе при проведении второго этапа операции соединительнотканные волокна занимали уже 17 [12,4; 21,3] % от общей площади среза. Значения исследуемого параметра между группами на 4-й и 5-й неделях исследования достоверно отличались от значений 3-й недели. В завершение, на 6-й неделе исследования, площадь соединительнотканных волокон составила 25 [16,3;30,1] %, отличия с группами на более ранних сроках статистически значимы (рис. 1, С, 2).
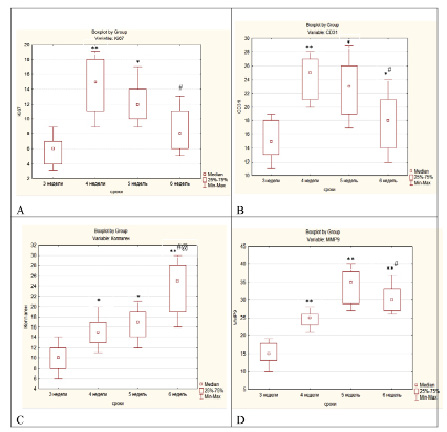
Рис. 1. Сравнительная характеристика групп исследования: А – процент Ki-67 позитивных клеток, B – количество CD31 позитивных сосудов, С – площадь коллагена, D – ММР-9 – количество ММР-9 позитивных клеток;
*, ** – достоверные различия всех групп от группы 3 недели, при р < 0,05 и р < 0,001 соответственно; #, ## – достоверные различия групп 5 и 6 от группы 4 недели, при р < 0,05 и р < 0,001 соответственно; @ – достоверное различие между группами 5 и 6 недель, р < 0,05
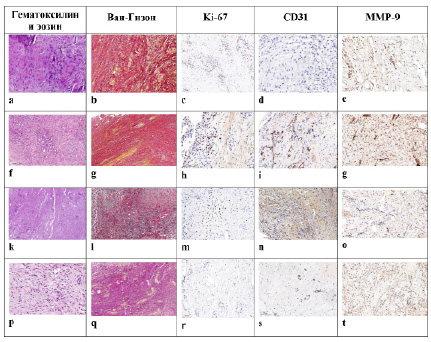
Рис. 2. Гистологическая и иммуногистохимическая характеристики индуцированной мембраны на различных сроках проведения второго этапа костной пластики по Masquelet; сроки проведения второго этапа операции: a-e – 3-я неделя, f-g – 4-я неделя, k-o – 5-я неделя, p-t – 6-я неделя
Анализ значений медианы индекса пролиферации Ki-67 показал следующее (рис. 1, А): в первые три недели после проведения второго этапа операции значения показателя составили 6 [3,1; 9,2] %. На 4-й неделе индекс пролиферации вырос до 15 [9,8; 19,5] %, а на 5-й неделе значение медианы индекса пролиферации составило 12 [9,6; 17,1] %. Отмеченный рост пролиферативной активности в этом периоде исследования носит достоверный характер, отличия между группами статистически значимы. Однако на 6-й неделе, при проведении второго этапа операции, индекс пролиферации составил 8 [5,3; 13,7] %, что уже достоверно ниже, чем показатель на 4-й неделе (рис. 1, А, 2).
Среднее число сосудов, окрашенных позитивно на маркер CD31 (рис. 1, В) в группе проведения второго этапа операции через 3 недели, составило 15. На сроке исследования 4 недели после проведения второго этапа, среднее число CD31 позитивных сосудов составило 25 [20,6; 28,3], после чего отмечено снижение значений медиан исследуемого показателя: 23 [17,4; 28,6] через 5 недель и 18 [12,4; 24,5] – через 6 недель (рис. 1, 2). Выявленные изменения аналогичны изменению показателя Ki-67: значительный достоверный рост на 4-ю и 5-ю неделю и снижение на 6-ю неделю, приближающееся по числовым показателям к 3-й неделе.
Среднее число клеток, окрашенных позитивно на маркер ММР-9 в группе трех недель после проведения второго этапа операции, составило 15 [10,4;19,1] %. На сроке 4 недели среднее число ММР-9 позитивных клеток составило 25 [21,2;28,7] %. На более поздних сроках исследования (5-я неделя проведения второго этапа) – 35 [27,8;40,9] %. На сроке 6 недель от начала эксперимента 30 [26,2;37,6] % (рис. 1, 2). Изменения данного показателя были наиболее существенны по сравнению с остальным критериями исследования. Достоверность в группах 4, 5 и 6 недель относительно 3-й недели была высокой, при р < 0,001 и такое повышение носило стойкий характер без достоверного снижения на 6-й неделе.
В работе O.M. Аhо с соавт. указывали на то, что гистологически в остеоиндуцированных мембранах обнаруживается эндохондральная оссификация [13], а F. Gruber с соавт. сообщили о результатах гистологического исследования, которое показало наличие трабекулярной кости в 33,3 % полученных образцов [16].
В представленных в данной статье результатах исследования получены аналогичные результаты в ограниченном количестве образцов на 4–5-й неделе после проведения второго этапа операции. Это можно объяснить причинно-следственным механизмом: богатая кровеносная система может стимулировать образование кости внутри имплантата. Богатая сосудистая система, остеогенная и остеоиндуктивная активность являются ключевыми компонентами имплантата [14, 16, 17].
Гистологически в данном исследовании не выявлено наличие воспаления, реакции на инородное тело и фиброз в образцах индуцированной мембраны, что объясняется применением антибиотиков во время первого этапа операции. Относительно небольшое количество образцов индуцированной мембраны от человека (12) не является признаком неадекватности результатов исследования. Например, следующие авторы также работали с малыми выборками: R.J. Cuthbert и соавт. [14] обследовали 8 пациентов, F. Gruber и соавт. [16] включили в исследование 12 пациентов, а O.M. Aho и соавт. [13] посчитали достаточным данные материала от групп, сформированных 14 пациентами.
Кроме того, были установлены сроки наибольшей активности индуцированной мембраны (4–5 недель после установки имплантата), что очень важно для планирования и успешного проведения второго этапа пластики по Masquelet. Полученные результаты свидетельствуют о взаимосвязи между васкуляризацией и остеогенезом внутри имплантата и служат основой для дальнейших исследований в этой области.
Заключение
Таким образом, проведенное исследование подтвердило, что индуцированная мембрана на сроках 4–5 недель проведения второго этапа пластики обладает наиболее высокой пролиферативной активностью, а также высоким неоангиогенезом: на 4-й неделе после проведения второго этапа операции медиана значения числа CD31 позитивных сосудов была максимальной – 25 [20,6; 28,3]. На более поздних сроках исследования (5-я неделя от начала эксперимента) – 23 [17,4; 28,6]. Было установлено высокое содержание матриксных металлопротеиназ 9 (ММР-9), повышение которых начиналось с 4-й недели после первого этапа операции: на этом сроке медиана ММР-9 позитивных клеток составила 25 [21,2; 28,7] %, на 5-й неделе проведения второго этапа – 35 [27,8; 40,9] %, а на сроке 6 недель от начала эксперимента – 30 [26,2;37,6] %. Соответственно, количество ММР-9 положительных клеток имело максимальное значение на 5-й неделе и также сохранялось высоким на 6-й неделе. Полученные результаты свидетельствуют о взаимосвязи между васкуляризацией и остеогенезом внутри имплантата и служат основой для дальнейших исследований в этой области.
 science-review.ru
science-review.ru