В иммунной системе млекопитающих различают три основные группы органов: 1) центральные (костный мозг и тимус); 2) периферические (селезенка, лимфатические узлы и Пейеровы бляшки); 3) лимфоидная ткань, ассоциированная со слизистыми оболочками. Эволюционно раньше других появляется иммунная система желудочно-кишечного тракта, призванная предотвращать проникновение микроорганизмов и аллергенов пищи в слизистую кишечника [6].
Выделяют клеточный и гуморальный типы иммунного ответа, а также неспецифи-ческую реакцию организма, опосредованную системами мононуклеарных фагоцитов, комплемента и т.д. Все типы иммунного ответа – это звенья единого механизма поддержания гомеостаза организма, осуществляемого иммунной системой. Сила иммунного ответа определяется генами главного комплекса гистосовместимости (Major Hystocompatibility Complex – MHC) и модулируется многими экстракорпоральными факторами (рис. 1).
В-лимфоциты имеют костно-мозговое происхождение, созревают и дифференцируются в ростовых зонах лимфатических узлов. Cозревание и селекция основной массы Т-лимфоцитов происходит в тимусе из бластных предшественников костномозгового происхождения и сопровождается последовательной экспрессией на поверхности клетки гликопротеинов, обозначаемых согласно общепринятой номенклатуре как CD-антигены: CD2, CD3, CD4, CD5, CD8, CD25, CD44 и т.д., начиная от CD2+CD3-CD4-CD8- проТ-клеток через стадию двойных негативных тимоцитов CD3+CD4-CD8- и двойных позитивных тимоцитов CD3+CD4+CD8+ к клеткам зрелого фенотипа – CD2+CD3+CD4+ или CD2+CD3+CD8+. Cелекция в тимусе происходит на стадии CD4+CD8+. Клетки, имеющие рецепторы к молекулам MHC I класса, дифференцируются в CD8+ лимфоциты, а несущие рецепторы к молекулам MHC II класса становятся CD4+ лимфоцитами [103].
Позитивная селекция происходит при блокировании программы гибели клетки, а клональная делеция – при ее активации. Аутореактивные лимфоциты выходят в апоптоз и фагоцитируются макрофагами [101].
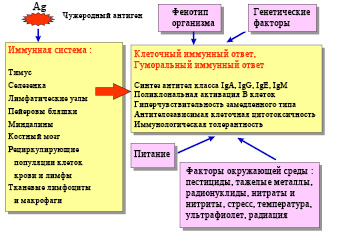
Рис. 1. Факторы, определяющие развитие иммунного ответа
От 1 до 5% зрелых СD4+- или СD8+-тимоцитов попадают в кровь и далее в селезенку, регионарные лимфатические узлы и ткани [46]. Приблизительно 30-40% периферических иммунокомпетентных Т- и В-лимфоцитов обновляются каждые три дня; в течение 10 дней происходит обмен подавляющего большинства В-лимфоцитов [37].
Значение экспрессии поверхностных антигенов лимфоцитов в активации и дифференцировке клеток
Рецептор Т-лимфоцита представляет собой комплекс молекул, включающий TCR/CD3 комплекс и гликопротеин CD4 (или CD8), выполняющий функцию ко-рецептора и распознающий молекулы MHC II класса (или молекулы MHC I класса для CD8). Поверхностный антиген CD4 фенотипически характеризует популяцию хелперных клеток, координирующих иммунный ответ на Т-зависимые антигены. CD8 антиген характеризует лимфоциты, преимущественно выполняющие цитотоксические или супрессорные функции [101].
Иммунологическое распознавание предполагает взаимодействие процессированного антигенного пептида (Ag) в комплексе с двумя молекулами МНС с активным центром TCR/CD3-комплекса. При этом фосфорилируются рецептор-ассоциированные протеинтирозинкиназы и далее сигнал передается по каскаду вторичных мессенджеров, включающих, в частности, фосфатидилинозит-4,5-бифосфат, фосфолипазу Сγ1 и диацилглицерин – специфический активатор протеинкиназы С, что приводит к мобилизации внутриклеточного [Ca2+]i. Далее через систему митоген-активированных протеинкиназ сигнал передается на ядерные факторы транскрипции и далее к протоонкогенам c-fos, c-myc, c-jun. Активируются так называемые «ранние гены», в том числе ген интерлейкина IL-2. Прямым следствием стимуляции лимфоцита является синтез IL-2, являющегося регуляторным цитокином, необходимым на всех стадиях иммунного ответа и потенцирующим образование ряда других цитокинов, например фактора некроза опухоли альфа (TNF-α) и гамма-интерферона (IFN-γ) [63].
Дифференцировка CD4+-клеток в Th1 или Th2 происходит при генетически-контролируемом взаимодействии лимфоцита с Ag-презентирующей клеткой. CD4+Th1-лимфоциты продуцируют IL-2, IL-12, а также IFN-γ, TNF-α и TNF-β, тогда как CD4+Th2-клетки продуцируют интерлейкины IL-4, -3, -5, -6, -10, при этом IL-4 и IL-10 ингибируют образование Th1-субпопуляции, снижая их пролиферативный потенциал, а IFN-γ ингибирует образование Th2 [7]. IL-4 необходим для синтеза иммуноглобулина IgG1 митоген-активированными В- лимфоцитами и для экспрессии на В- лимфоцитах рецептора CD40, блокирующего программу гибели активированных В- клеток. IL-6 секретируется также антиген-презентирующими клетками и является связующим звеном между так называемым «природным» и клеточным видами иммунного ответа, стимулируя дифференцировку «наивных» CD4+-клеток в Th2-лимфоциты [7].
Значение миграции и молекул адгезии в поддержании иммунного статуса in situ
При развитии иммунного ответа специфические предшественники клеток-эффекторов пролиферируют в особом микроокружении лимфоидной ткани, затем они дифференцируются в эффекторные лимфоциты и мигрируют из лимфоидных органов в кровь и ткани. Миграция зависит от распределения Ag в организме и локальной активации лимфоцитов молекулами МНС, наличия факторов миграции и т. д. Взаимодействие всех типов клеток-эффекторов приводит к выведению чужеродного антигена из организма [100].
Молекулы адгезии представляют собой трансмембранные белки, участвующие в межклеточном распознавании, прикрепление иммунных и других клеток к эндотелию или экстраклеточному матриксу. Связывание молекул адгезии их лигандами инициирует дополнительные сигналы, необходимые для активации иммунных клеток и развития полноценного иммунного ответа.
Молекулы адгезии распределены между тремя семействами: суперсемейство иммуноглобулинов Ig, семейство интегринов и семейство селектинов [105]. Селектины P, E и L играют роль в адгезии лейкоцитов к активированному эндотелию и их продвижению через сосудистый барьер в лимфоидную ткань или область воспаления.
К молекулам адгезии суперсемейства Ig относятся ICAM-1, ICAM-2, ICAM-3 (Inter Cellular Adhesion Molecule), VCAM-1 (Vascular Cell Adhesion Molecule), CD31 (PECAM-1) и MAdCAM-1, которые связывают интегрины на лейкоцитах и обусловливают их проникновение в стенку сосуда и далее в окружающие ткани. Семейство интегринов служит рецепторами для ICAMs и VCAMs. Интегрины – это гетеродимерные белки, α и β цепи которых отвечают за адгезию лейкоцитов к эндотелию сосудов и межклеточные контакты. Схема действия молекул адгезии представлена на рис. 2.
Другие белки, функционально относящиеся к молекулам адгезии, участвуют в усилении ассоциации Т-лимфоцитов с Ag-презентирующей клеткой или клеткой мишенью, а также принимают участие в активации лимфоцитов. Такие молекулы адгезии как CD44 отвечают за движение лимфоцитов при их возвращении из лимфоидной системы обратно в циркуляцию. Некоторые формы CD44 важны для метастазирования.
Клетки эндотелия через Р- и Е-селектины (P-selectin, E-selectin) получают предварительный сигнал при касании лейкоцита, экспрессируют лиганд для L-селектина (L-selectin ligand), который взаимодействует с растворимой формой рецептора (sL-selectin). Лейкоцит прикрепляется к эндотелию, получает дополнительные сигналы от взаимодействия интегринов (LFA-1, ICAM-1), что способствует реструктуризации цитоскелета и проникновению клеток через сосудистую стенку в окружающие ткани. Клетки эндотелия также секретируют цитокины, например, IL-1, IL-4, TNF-α, IFN-γ, играющие роль факторов дифференцировки и развития клеток иммунной системы.
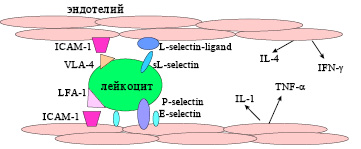
Рис. 2. Влияние молекул адгезии на продвижение клеток из сосудистого русла в ткани.
В тимусе позитивная и негативная селекция лимфоцитов зависит не только от взаимодействия TCR и MHC, но и от межклеточного распознавания через молекулу LFA-1. На покоящихся лимфоцитах LFA-1 не связывает ее лиганд – ICAM-1. При активации Т-клет-ки через TCR/CD3 комплекс повышается авидность LFA-1 и ICAM-1, что дает Т-лимфоци-там дополнительный акцессорный сигнал через ICAM-1. В незрелых тимоцитах одно-временное распознавание рецепторов CD3 и LFA-1 повышает мобилизацию кальция, а также экспрессию рецептора Bcl-2 – протектора апоптоза [103].
Повышение экспрессии молекул адгезии, в результате появления в тканях чужеродного антигена, приводит к повышению синтеза макрофага IL-12, который, в свою очередь, способствует дифференцировке Т-клеток в Т-h1 и синтеза ими INF-γ. Повышение синтеза макрофагами IL-12 и IL-6 значительно усиливает пролиферацию Т-лимфоцитов и заселение ими нелимфоидных тканей [31].
Апоптоз как регуляторный механизм иммунитета
Пик первичного иммунного ответа приходится на 3-5 день и затем эффекторные Т-лимфоциты выходят в апоптоз [102]. При этом повышается число рецепторов TNF-α, TNF-β, Fas-R и других, связывание которых специфическими лигандами приводит к программированной гибели клеток – апоптозу [73]. Апоптоз является активным генно-регулируемым процессом, морфологически характеризуемым конденсацией хроматина, реорганизацией цитоскелета, потерей контакта с экстраклеточным матриксом, фрагментацией ДНК и цитоплазмы, фагоцитозом изолированных клеточных компартментов без контакта их содержимого с внешней средой, что отличает апоптоз от некроза или других типов распада клеток [94].
Апоптоз непосредственно связан с регуляцией гомеостаза в организме, является механизмом негативной селекции тимоцитов, поддерживает периферическую иммунологическую толерантность, способствует выведению из организма клонов клеток-эффекторов при завершении иммунного ответа [91].
С точки зрения биохимических процессов, происходящих в лимфоцитах при апоптозе, его условно можно разделить на несколько видов: активационно-индуцированный, глюкокортикоид-индуцированный, Fas-зависимый, TNF- индуцированный, bcl/bcx-зависимый, гранзим- и перфорин-зависимый, каспазо-зависимый и т. д. [76].
Процессы созревания и дифференцировки лимфоцитов в тимусе регулируются несколькими типами апоптоза, что зависит от рецептора, через который проводится сигнал для активации программы гибели клетки [30].
Образованные в результате фрагментации цитоплазмы так называемые апоптозные тельца фагоцитируются макрофагами. В тимусе F4/80+ макрофаги имеют малый диаметр и располагаются в корковой зоне рядом с тимоцитами, выходящими в апоптоз, так как обладают высокой скоростью поглощения апоптозных телец [96, 101].
Наиболее важным представляется рассмотрение активационно-индуцированного и Fas- зависимого апоптоза, так как изучаемые в данной работе токсические вещества запускают именно эти типы апоптоза. Распознавание и выведение нефункциональных или аутореактивных лимфоцитов осуществляется макрофагами [91]. Уже на ранних стадиях апоптоза нарушается асимметрия фосфолипидов плазматической мембраны и на поверхности клетки появляется фосфатидилсерин, что распознается макрофагами через специфический рецептор, как сигнал для фагоцитоза [103].
Активационно-индуцированная гибель клеток является одним из регуляторных механизмов иммунной системы. Основной задачей этого типа апоптоза является выведение из организма зрелых периферических Т-лимфоцитов, которые были активированы через TCR/CD3 комплекс или ко-рецепторы CD4 или CD8, но в отсутствие специфического антигена не могут стать эффекторами [82]. Активация незрелых тимоцитов или трансформированных Т-лимфоцитов через TCR/CD3 комплекс также ведет к апоптозу.
Активационно-индуцированный апоптоз может быть при распознавании рецептором CD4+ Т-лимфоцита растворимого комплекса, состоящего из антигенного пептида и молекулы MHC II класса, который в норме должен быть представлен на мембране антиген-презентирующей клетки, что сопровождается дополнительными сигналами от других мембранных рецепторов [93].
Нарушение активации факторов транскрипции, снижение тирозинкиназной активности, ослабление контакта с экстраклеточным матриксом [82] так или иначе влияют на процессы созревания и дифференцировки лимфоцитов, что отражается на количестве клеток, несущих CD3, CD4, CD8, CD25 и другие антигены, а также приводит к изменению плотности и аффинности рецепторов.
Fas-зависимый апоптоз в лимфоцитах является регуляторным механизмом, препятствующим накоплению эффекторных клеток и нерегулируемой продукции цитокинов. Удаление эффекторных CD4+- и CD8+-лимфоцитов после реализации иммунного ответа осуществляется Fas-зависимым путем, который инициируется при связывании лигандом рецептора CD95/Fas/APO-1, реализуется через Ras-сигнальный путь, в котором одной из обязательных ступеней является транзиторный синтез активных форм кислорода [49].
В периферических Т-лимфоцитах Fas-зависимый апоптоз является одним из двух основных механизмов эффекторной функции цитотоксических лимфоцитов при киллинге клеток-мишеней [52]. Повышение экспрессии CD95 /Fas/APO-1 рецептора на мембране нестимулированного CD4+ лимфоцита повышает вероятность его выхода в апоптоз [74].
Иммунная система как мишень комбинированного воздействия факторов внешней среды
Иммунная система играет критическую роль в поддержании гомеостаза организма, однако при определенных условиях сама может оказаться мишенью для различных токсических веществ из окружающей среды, включая пестициды, тяжелые металлы, нитраты, нитриты и т.д., которые по воздействию на иммунную систему могут рассматриваться как иммунодепрессанты, иммуностимуляторы, Т-зависимые антигены, Т-независимые антигены, гаптены или митогены.
Иммунодепрессивные состояния являются основой для развития оппортунистических инфекций и опухолей, тогда как иммуностимуляция повышает риск развития аутоиммунных заболеваний и аллергических реакций. Иммунотоксическое действие вредных веществ на человека изучают при скрининге биологических жидкостей или при исследовании биопсийного материала.
Биологическая активность токсических веществ обычно изучается на различных видах животных, используемые при этом высокие дозы не соответствуют реальным дозам, получаемым человеком, и, кроме того, многие эффекты являются видоспецифическими [9]. Однако модельные системы на животных позволяют определить клетки или органы мишени действия токсикантов. При этом «первично-иммунотоксическими» считаются вещества, приводящие к изменению иммунологических параметров в обычных дозах, тогда как подобный эффект для веществ в сверхвысоких дозах считается «непрямым, или вторичным иммунотоксическим» [104].
Альтернативное использование моделей, основанных на культивировании клеток или клеточных линий в присутствии токсических веществ, могут отражать пути метаболизма веществ в органах-мишенях. Однако также возможно видоспецифическое различие: малатион, например, в 5 раз повышал образование микроядер в клетках крысы, но был неэффективен в тех же дозах в отношении лимфоцитов человека [102].
Влияние пестицидов на иммунитет
Пестициды это органические и неорганические вещества различных классов, используемые для борьбы с вредителями сельского хозяйства, переносчиками опасных заболеваний человека, а также регуляторы роста растений и дефолианты. В зависимости от мишени воздействия пестициды делятся на инсектициды, гербициды, зооциды, фунгициды и т.д. [24]. По токсичности пестициды делятся на сильнодействующие, высокотоксичные, среднетоксичные и малотоксичные. Подобное разделение лежит в основе классификации Международного агентства по изучению рака [57]. Имеется также классификация пестицидов, одобренная Институтом гигиены им. Эрисмана, по их канцерогенности, включающая чрезвычайно опасные, опасные, умеренно опасные и мало опасные пестициды [5].
По химическому составу пестициды можно разделить на
1) хлорорганические (р,р’-ДДТ и его метаболиты: р,р’- ДДЕ, p,p’-ДДД, и др.),
2) фосфорорганические (хлорпирифос, фентион, малатион или карбофос, темефос, диметоат, метилпаратион, фолидол и т. д.),
3) циклодиеновые (диелдрин),
4) пиретроиды (бифентрин, перметрин),
5) карбаматы (иетонил, карбамил, альдикарб, ZZ-афокс),
6) полихлорированные дибензофураны,
7) полихлорированные бифенилы,
8) полихлорированные дибензо-р-диоксины (фуран),
9) метаболиты нафталина,
10) триазины (атразин),
11) хлорфеноксикислоты
и др., а также тяжелые металлы и микробные пестициды (например, Bacillus thuringiensis и Bacillus sphaericus).
В настоящее время одну четверть всего объема пестицидов занимают пиретроиды, обладающие низкой токсичностью для птиц и млекопитающих [60].
Способы экспозиции пестицидов на человека можно разделить на производственные и бытовые. Человек может заразиться пестицидами при их транспортировке и хранении, а также пылью с одежды или с водой [61]. У работающих с пестицидами людей существенно повышен процент заболеваемости астмой, контактным и аллергическим дерматитами, а также фотодерматитами. Все перечисленные заболевания имеют в патогенезе те или иные нарушения иммунной системы. У людей, постоянно контактирующих с водой, при очень низких концентрациях в ней пестицидов наблюдается эритематозный дерматит [40, 42, 101, 102].
Бытовая экспозиция к пестицидам может быть при контакте с поверхностью зараженных фруктов и овощей, при употреблении воды и пищевых продуктов, содержащих пестициды, а также при вдыхании воздуха в загрязненных районах [29, 95, 100]. Пестициды имеют свойство аккумулироваться в органах, тканях и биологических жидкостях человека и других млекопитающих в зависимости от конечных мишеней их действия [8, 71]. Фосфорорганические соединения и карбаматы, например, обладают нейротоксическими свойствами, ингибируют ацетилхолинэстеразу, снижают уровень ацетилхолина. При неонатальном развитии хлорпирифос вызывает снижение синтеза ДНК во всех отделах мозга [103]. Большинство дитиокарбаматов ингибируют также сывороточную допамин-β-гидроксилазу и транспорт допамина [102]. Линдан и эндосульфан повышают порог захвата медиатора в синаптической щели [44]. Контакт с пестицидами повышает риск развития опухолей мозга [51].
Контактная гиперчувствительность и аутоиммунная патология при экспонировании к пестицидам особенно часто наблюдаются у больных с пониженным питанием, детей и лиц пожилого возраста [105]. Пестициды хлордан и хлорпирифос могут усиливать имеющиеся иммунологические нарушения или хронические заболевания, протекающие на фоне иммунодефицитного состояния [103].
У лиц обоего пола, работающих с жидкими пестицидами, выявлено повышение сывороточного IgG и числа лейкоцитов, снижена адгезия нейтрофилов, снижено общее число Т-лимфоцитов, и также процент Т-хелперов и Т-супрессоров [65]. Длительный контакт людей с пестицидами, содержащими пентахлорфенол в дозе более 10 мкл/л снижает пролиферативный потенциал лимфоцитов в ответ на митогены, а также повышается уровень моноцитов в периферической крови, уровень IL-8 в сыворотке; соотношение Т-хелперов и супрессоров CD4/CD8 при этом снижается [26]. Экспозиция крыс к диметоату и метилпаратиону на протяжении трех поколений вызывала снижение массы тела и органов, снижение клеточности костного мозга, а также снижение числа плазматических клеток в селезенке, синтезирующих IgM; супрессировалось клеточное звено иммунного ответа, что отражалось на развитии ГЗТ [58].
Метилдитиокарбамат натрия снижает вес тимуса мышей и число CD4+CD8+ двойных негативных тимоцитов, снижает общий уровень лимфоцитов в периферической крови и активность натуральных киллеров. При этом повышается процентное содержание нейтрофилов в крови [62]. Гептахлор при однократном введении в дозе более 23 мг на кг приводил к некрозу лимфоцитов тимуса и селезенки, триадимефон снижал вес селезенки [17].
Как уже говорилось ранее, иммунная система желудочно-кишечного тракта играет существенную роль в общем гомеостазе организма. Атразин, диазинон, эндосульфан обладают митогенной активностью в отношении эпителия кишечника [45]. Интересно, что некоторые пестициды вступают во взаимодействие с микрофлорой кишечника. При этом фермент кишечной палочки параоксоназа расщепляет паратион и параоксон и приводит к детоксикации пестицидов [101]. Бактериальные фосфодиэстеразы гидролизуют фосфо-3-эфир-содержащие фосфорорганические пестициды [23,27].
In vitro, малатион обладает генотоксичностью и способностью ингибировать пролиферацию лимфоцитов крысы [102]. Подобные тесты на лимфоцитах людей, экспонированных к малатиону, выявили существенные межиндивидуальные различия, однако установили специфическое мутагенное действие малатиона на Т-лимфоциты человека [106].
Следует обратить внимание на влияние пестицидов на мононуклеарные клетки периферической крови. Существует весьма распространенный способ тестирования мутагенной активности пестицидов по частоте хромосомной аберрации, обмену сестринских хроматид и образованию микроядер в лимфоцитах. Митогенная активность определялась по уровню синтеза ДНК, митотической активности, проценту диплоидных клеток. Генотоксичность определяется по SOS-хроматесту и тесту Эймса. Слабой генотоксичностью обладают каптал и капафон [103], а также алахлор, фенпропатрин, перметрин, трифлюрамин [101]. Большинство хлорорганических пестицидов обладают слабым генотоксическим действием [72]. Существенно, что различные смеси этих веществ не обладают аддитивным эффектом в плане повреждения ДНК [18, 81], Гексахлорбензин рассматривается как слабый генотоксичный канцероген [21]. Частота аберрации хромосом в лимфоцитах периферической крови людей, экспонированных к пестицидам, повышается более чем в 3 раза при повышении интенсивности контактов с пестицидами и снижается по мере их ослабления [22, 70, 88]. ДДТ и бромпропилат дозо-зависимо влияет на митоз (s-митоз) [69] Комбинированное воздействие малатиона и γ-излучения на культивируемые лимфоциты человека в G0 фазе клеточного цикла приводит к усилению фрагментации хромосом и хроматид [3].
Существенным моментом в этих исследованиях является то, что лимфоциты представлены как коротко-живущими клетками, так и долго-живущими, имеющими фенотип клеток памяти [37]. Однократное воздействие пестицидов приводит к изменению иммунного статуса организма на некоторый непродолжительный период времени. Экспонирование организма в течение этого периода к чужеродным антигенам приведет, вероятно, к нарушению иммунного ответа. С появлением новой генерации лимфоцитов способность отвечать на антигены восстанавливается. Однако хромосомные нарушения могут сохраняться в долгоживущих популяциях лимфоцитов, представленных в основном клетками памяти. Это может привести к нарушениям при вторичном иммунном ответе.
Учитывая единство нейро-эндокринно-иммунной регуляторной цепи, следует также обратить внимание на пестициды, способные изменять гормональную активность в связи с их возможным иммуномодулирующим действием [43, 89, 106]. К так называемым «эндо-кринным модуляторам» относятся 1) полихлорированные бифенилы, о,р’-ДДТ и другие фосфорорганические соединения с активностью агонистов рецепторов эстрогена;2) p,p’-ДДЕ, действующий как лиганд рецептора андрогена, обладающий антиандрогенной активностью; 3) производные диоксина, связывающие арилуглеводородный рецептор и обладающие тканеспецифической антиэстрогенной активностью; 4) гидроксилированные ароматические пестициды, связывающие транстиретин – белок, связывающий тироксин [89, 105]. Эндокринная модуляция проявляется в снижении фертильности животных и гибели эмбрионов, неопластическом росте, изменении гормонального статуса, включая уровень андрогенов, изменении сексуальной дифференцировки в неонетальном периоде, подавлении функции щитовидной железы [36]. Смеси пестицидов, по отдельности не проявляющих эстрогенной активности, могут повышать синтез эстрогена путем связывания нескольких сайтов эстрогеновых рецепторов на эстроген-чувствительных клетках, а ДДТ, кроме того, повышает в этих клетках активность циклин-зависимой киназы cdk2 и активность ядерного фактора транскрипции -1 [28].
При хроническом воздействии пестицидов на организм, повышении частоты мутаций и митогенной активации клеток повышается вероятность развития лимфопролиферативных заболеваний, в том числе не-Ходжкинской лимфомы, лимфомы Ходжкина, хронического лимфолейкоза и множественной миеломы [11, 103]. Было показано, что инсектициды и фунгициды достоверно чаще по сравнению с контролем повышают частоту разрывов хромосом. При этом активируются онкогены, гены апоптоза и супрессии опухолей. [41].
Фосфорорганические соединения, тиофосфаты и дитиофосфаты могут выступать в качестве гаптенов: при конъюгации с белком при участии диоксафосфоринан-метоксиацетиловой кислоты были высокоиммуногенными и давали существенные титры специфических антител [102].
Опосредованные изменения иммунного ответа при попадании в организм пестицидов могут быть вследствие синтеза арахидоновой кислоты и повышенной продукции эйкозаноидов, что показано для ДДТ и полихлорированных бифенилов [48]. Действие пестицидов может опосредовано изменить иммунный ответ, в связи с их способностью активировать протеинкиназу С [14], ингибировать протеин-фосфатазы А2 и 1 [34], служить лигандом для Р-гликопротеина [15] и ингибировать синтез белка [18], что может влиять на сигнальные пути в иммунных клетках.
Соли тяжелых металлов как иммуномодуляторы
В связи с использованием в предыдущие годы солей тяжелых металлов в качестве пестицидов и их способностью к аккумуляции в тканях и органах, а также загрязнением ими окружающей среды [22] были проведены исследования о характере влияния их на показатели клеточного и гуморального иммунного ответа у людей и животных.
Для свинца показана дозо-зависимая стимуляция гуморального иммунного ответа с повышением числа В-лимфоцитов и продукцией неспецифических Ig [101]. При этом снижается резистентность к бактериальной и вирусной инфекции за счет повышения продукции аутоантител [53].
Хроническое отравление свинцом также приводит к изменению Т-клеточного иммунного ответа и индукции гиперчувствительности замедленного типа (ГЗТ) на фоне повышенного образования Т-хелперов второго порядка и синтеза соответствующих цитокинов [53]. У мышей хлорный свинец повышал образование IL-4 клонами Th2 in vitro и приводил к снижению продукции IFN-γ клонами Th1. При этом были повышены уровни сывороточного IgE и IL-4 [53]. При введении хлорного свинца или хлорной ртути у мышей наблюдалась олигоклональная активация CD4+ клеток селезенки. Недифференцированные тимоциты не отвечали митогенной стимуляцией. Как и в предыдущей работе, было показано переключение образования Th2 вместо Th1 под действием свинца [54]. При одновременном введении антигена и свинца отмечалась поликлональная активация В-клеток с продукцией Ig класса E, повышение синтеза IgG1и снижение синтеза IgG2a. Существенно, что свинец вызывал переключение образования Т-хелперов второго порядка даже в отсутствие антигенной стимуляции, хотя на более низком уровне. Подобные нарушения регуляции приводят к аутоиммунным заболеваниям и снижению показателей клеточного иммунитета [54].
Механизм действия свинца предположительно связан с активацией [Ca2+]i / кальмодулин-зависимой протеинкиназы 2-го типа, в связи, с чем требуется обязательное присутствие Ca2+ для реализации действия свинца [109]. Свинец также приводит к сниже-нию уровня АТФазы, ацетилхолинэстеразы и моноаминооксидазы [97].
Следует обратить внимание на то, что нарушение функционального состояния именно Т-хелперов первого порядка характерно для тяжелых металлов. Таким свойством обладает также железо [87].
Свинец, медь и другие тяжелые металлы имеют свойство аккумулироваться в тканях животных морских и речных пищевых цепей. При постоянном употреблении в пищу таких продуктов тяжелые металлы попадают в организм человека и вызывают хроническую интоксикацию, сопровождающуюся изменением реактивности организма [102]. Однако кратковременный контакт с тяжелыми металлами не приводит к существенным нарушениям [106]. В следовых количествах такие элементы как медь, кобальт, молибден, ванадий и др. обладают определенными протективными свойствами [56].
Важным моментом является то, что с возрастом происходит накопление тяжелых металлов в тканях и сыворотке людей [104], что приводит к активации металлопротеинов, в частности медь-содержащий аминооксидазы [35], а также повышению риска развития рака. Ассоциация с повышенным риском развития опухолей у человека показана при накоплении кадмия [10]. Медь и ее соли повышают риск развития неходжкинской лимфомы [38]. Ртуть повышает частоту обмена сестринских хроматид [75] и повреждает мембраны эритроцитов [12].
Канцерогенный эффект тяжелых металлов прямо связан с их способностью выступать в роли эндогенных окислителей ДНК. Существует целый пласт взаимосвязанных проблем, касающихся метиллирования ДНК, образования реактивных метаболитов кислорода и их взаимодействия с реактивными метаболитами азота.
Действие нитратов и нитритов на клетки иммунной системы
Нитраты и нитриты являются составной частью пищи и пищевых добавок. Основной источник нитратов – это овощи, кроме того, эндогенный синтез нитратов составляет около 1 мг на кг веса в день и может быть существенно повышен при некоторых воспалительных заболеваниях. Источником нитритов являются мясные продукты. При этом нитраты овощей превращаются в нитриты.
Эндогенный синтез нитрозоаминов может быть при одновременном присутствии в пище донаторов аминных групп и нитрозообразующих агентов (нитрит или окись азота).
Окись азота (NO) играет ключевую роль в неспецифической резистентности организма и образуется фагоцитами в ответ на бактериальные и клеточные антигены. Активированные нейтрофилы и макрофаги продуцируют как интермедианты кислорода, так и азота [39]. При этом донаторы NO-групп, в частности, экзогенные нитраты, нитриты, N-нитрозоамины и индукторы эндогенного синтеза нитрозоаминов, являются ингибиторами цитотоксической функции макрофагов [80]. NO также рассматривается как вторичный мессенджер в передаче сигналов в клетке, особенно связанных с индукцией апоптоза. NO-синтаза активируется в ответ на бактериальные стимулы в макрофагах и рассматривается как важный фермент в реализации бактериостатической функции. NO-синтаза ингибируется IL-13 через активацию фосфатидилинозитол-3-киназы (PI-3K). Ингибиция этой киназы приводит к активации синтеза NO в клетке [77, 103].
Эндогенно-образованные нитриты, например, пероксинитрит, являются индукторами апоптоза в клетке. Накопление N-нитрозоаминов и ПАУ приводит к изменению ферментной системы цитохромов Р450, b5, NADPH-цитохром с редуктазы и др. [106], что приводит к развитию окислительного стресса и повреждению тиол-содержащих протеинов, играющих роль во многих клеточных процессах [102].
Известный генотоксический эффект нитрозоаминов связан с метиллированием или окислением ДНК. Предполагается также, что активные метаболиты азота связываются с ядерным фактором транскрипции TN-kB и способны регулировать апоптоз через взаимодействие с сигнальными путями TNF [85]. Вероятно, следует различать сигнальные пути с метаболитами азота как вторичными мессенджерами в макрофагах и лимфоцитах. В дифференцированных и высокоспециализированных клетках генерация реактивных метабо-литов азота выполняет скорее функцию переключения или ингибирования сигнальных путей, связанных с дифференцировкой и активацией клетки, тогда как в макрофагах метаболиты азота выполняют скорее киллерную функцию. Из этого следует, что влияние экзогенных нитросоединений будет оказывать тканеспецифическое действие на клетки. Цитокины, продуцируемые Т-хелперами как первого, так и второго порядка предотвращают образование нитратов и нитритов макрофагами [90].
Интересными представляются данные по утилизации атома азота медь-содержащей нитритредуктазой в некоторых бактериях, когда нитрит связывает сначала синглетный кислород с высвобождением NО, затем высвобождается атом кислорода и азот связывается с медью [92]. Для ферментной системы человека это не показано, однако, такой механизм взаимодействия нитритов с медь-содержащими ферментами может иметь существенное значение при образовании реактивных метаболитов кислорода при введении в организм нитрата и меди.
Механизмы токсического действия ксенобиотиков
Пестициды являются субстратом для ферментов, метаболизирующих ксенобиотики, таких как цитохромы системы Р450, флавинсодержащие монооксигеназы, а также могут выступать как активаторы или ингибиторы этих ферментов [47]. Индукция цитохрома Р450 – это общеклеточный защитный механизм детоксикации ксенобиотиков. Пестициды повышают активность гена Р450 2В10 и 1А и 3А4 связывающую активность ядерного фактора 1 и ядерных рецептор-подобных факторов [20, 33, 55, 99]. Сочетанное введение полихлорированных бифенилов и арохлора, а также железа, приводит к резкой активации цитохрома 1А1 и окислительному стрессу на фоне падения глютатион-пероскидазной активности [79]. Однако повышение активности этой системы может привести и к образованию еще более токсичных метаболитов [86,104]. Так, цитохром Р2Е1 способен образовывать интермедианты, являющиеся промоторами для цитотоксической или канцерогенной активности ксенобиотиков. Пестициды активируют этот фермент системы цитохрома Р450, что повышает риск токсичности их метаболитов [84, 100, 103].
Пестициды различных классов приводят к образованию липидных гидроперекисей и реактивных кислородных радикалов, которые вызывают окислительное повреждение ДНК и ее фрагментации [13,25, 105]. Повреждение ДНК является одним из механизмов запуска апоптоза [19]. Комбинированное воздействие пестицидов, солей кадмия и свинца, а также нитритов приводит к повышению процессов перекисного окисления липидов (ПОЛ) в тканях, активации каталаз, пероксидаз, оксиредуктаз. Ацефат, метамидофос, малеиновый гидразин и никотин ингибируют супероксиддесмутазу (СОД) эритроцитов [32]. Повреждение антиоксидантной системы сопровождается дальнейшим накоплением продуктов ПОЛ, что является наиболее существенным патогенетическим фактором действия пестицидов [32].
Одним из методов определения окислительного повреждения ДНК может быть измерение уровня 8-ОН-2-дезоксигуанозина, положительную реакцию на который дают фосфорорганические пестициды хлорпирифос и фентион, а также алахлор, ендрин, хлордан. Пентахлорфенол и его метаболиты повышают как уровень 8-ОН-2-дезоксигуанозина, так и обрыв ДНК, что может быть в результате действия радикалов кислорода [64, 78].
Таким образом, повышение активности оксидазоредуцирующих ферментов (например, с помощью селена) является патогномоничным в предупреждении эффекта комбинированного действия этих веществ.
Селен – это необходимый элемент питания человека, включение его в диету является одним из требований противораковой защиты. Протективная роль селена, в иммунном ответе, связана с селенопротеинами, которые в клетках млекопитающих играют роль в антиоксидантной защите. В Т-лимфоцитах тиоредоксинредуктаза представляет собой фермент, включающий селен в С-концевой регион и играющий роль в антиоксидантной системе наряду с такими известными системами как глютатион-пероксидаза.
Цитозольная форма селен-зависимой глютатионпероксидазы детоксицирует как водород, так и липидные гидроперекиси и является основным компонентом антиоксидантной защиты лимфоцитов. Посредством изменения уровня редуцированного глютатиона, селен может регулировать антиоксидантный потенциал Т-лимфоцитов человека.
Фосфорорганические пестициды снижают уровень селена в крови [59]. Повышение уровня свинца приводит к снижению концентрации селена в сыворотке крови [106]. Свинец в дозе 20 мг на кг массы при введении в течение 8 недель вызывает резкое падение активности гексокиназы, АТРазы, моноаминооксидазы и ацетилхолинэстеразы в структурах мозга крыс. Добавление селена восстанавливает активность ферментов [97].
 science-review.ru
science-review.ru