Одной из основных задач Национальной программы «Здоровье» основателем которого является Президент Туркменистана Гурбангулы Беодымухамедов – обеспечение населения страны лекарственными препаратами за счет лекарств отечественного производства,изучение возможности выращивания ценных лекарственных растений в условиях Туркменистана, разработка агротехники возделывания и обеспечение страны медицинскими препаратами и ценным сырьем для промышленности [1].
В современном мире большое внимание уделяется использованию в медицинской практике биологически активных препаратов растительного происхождения.
Мировая медицина ограничиваются от использования антибиотиков, так как снижается иммунная система и приводит к другим сложным последствиям. Ученые полагают, что в будущем антибиотики могут быть заменены супер-антителами, для которых не будет препятствием клеточная стенка, которые смогут проникать внутрь клеток и уничтожать болезнетворные бактерии, вирусы и токсины. Они испытывают технологию модификации антител, которая позволяет им свободно проникать в клетки и покидать их [1, 2–9, 12].
Авторы осознают, что при написании статьи не все задуманное удалось реализовать в полном объеме. Прекрасно понимают, что делают научный обзор по использованию лекарственных энзимов растительного происхождения в широком направлений, поэтому имеется недостатки как в теоретическом плане, так в прикладной, практической части. Но тем не мене вопрос использования нанотехнологии в генной инженерий и, прежде всего расшифровка геном человека позволяют создавать новые лекарственные препараты. Если будем лучше понимать роль генов в развитии болезней и то, как протекают процессы в наших клетках на наноуровне, сможем более целенаправленно вести исследования. С помощью генетики и биотехнологии сможем в будущем более эффективно выявлять причины заболеваний; тем самым исследования в области фармакология – это существенный шаг будет в деле создания инновационных лекарственных средств, устраняющих саму почину болезни. Большой интерес в этом предоставляют протеолитические ферменты растительного происхождения дынного древа [1–4].
Сделанный научно-информационый обзор, собранные материалы и методика подхода могут быть полезны для применения их не только в клинической медицине Туркменистана, но и в других странах мира.
Биотехнологические особенности дынного дерева
Ботаническое описание. Дынное дерево или папайя (Carica papaya L.) – многолетнее тропическое пальмоподобное растение высотой до 4–6 м семейства папаевых (Caricaceae). Ствол зеленый, травянистый, не деревенеющий, не имеет ветвей. Плоды свисают на черенках под кроной, сочные, очень большие (длиной до 10–30 см, массой до 1–4 кг), по размерам и форме напоминают дыню. Спелые плоды желтого цвета – съедобные, Внутри полость, наполненная черными семечками [2–9].
Лекарственное сырье. В качестве лекарственного сырья используют высушенный млечный сок – латекс. Коагулированные комья латекса крошат и высушивают на солнце или при легком искусственном подогревании (в последнем случае получают папаин более высокого качества). Полученный латекс растворяют в воде и осаждают спиртом для очистки папаина. В меньших количествах папаин содержится и в других частях растения, в частности в листьях (Folia Caricae Papayae) [2–4, 8–11].
Биологически активные вещества. Методом электрофореза в кислой среде в латексе Carica papaya L. идентифицировано 7 белков: липаза, хитиназа, лизоцим и комплекс протеолитических ферментов:
Папаин (EC 3.4.22.2) – монотиоловая цистеиновая эндопротеаза. По характеру ферментативного действия ее называют «растительным пепсином». Но, в отличие от пепсина, папаин активен не только в кислых, но и в нейтральных и щелочных средах (диапазон рН 3–12, оптимум рН 5) [2–4, 8–11, 17–20].
Химопапаин (EC 3.4.22.6) – монотиоловая цистеиновая протеиназа. Благодаря субстратной специфичности похожа на папаин, но отличается от него электрофоретической подвижностью, стойкостью и растворимостью [2–4, 12, 13].
Протеиназа IV – цистеиновая протеиназа, основная протеиназа латекса, составляет около 30 % присутствующего в нем белка (Buttle D. J. etc., 1989).Проявляет высокую степень гомологии с протеиназой III папайи (81 %), химопапаином (70 %) и папаином (67 %). Очень близка к химопапаину по молекулярной массе и заряду молекулы. Загрязнение этим ферментом химопапаина является причиной его гетерогенности в ходе исследований. M.P. Thomas и соавт. (1994) относят этот фермент к фракции химопапаина М [2–4, 8–11, 15, 16].
Карикаин (EC 3.4.22.30) – наиболее щелочная среди цистеиновых протеиназ латекса папайи. Подобно папаину, он сначала продуцируется в форме неактивного зимогена прокарикаина, содержащего ингибиторный прорегион из 106 N-терминальных аминокислот. Активация фермента заключается в отщеплении прорегиона молекулы без ее последующих конформационных изменений. Строение протеиназ папайи изучено с помощью рентгенструктурного анализа (Maes D. etc., 1996) [2–4, 11–18].
Протеиназа w (эндопептидаза А, пептидаза А) – монотиоловая цистеиновая протеиназа. Это полипептид, содержащий 216 аминокислотных остатков и 3 дисульфидные связи. Для проявления его ферментативной активности важно наличие свободного остатка цистеина в активном центре (Dubois T. etc., 1988). Проявляет высокую степень гомологии с папаином (68,5 %). По специфичности ферментативного действия напоминает папаин, поскольку связывается с субстратом в участках локализации дисульфидных связей. Расщепление происходит тогда, когда в следующей позиции находятся лейцин, валин или треонин. Пептидаза ІІ – щелочная монотиоловая цистеиновая протеиназа. В каталитическом центре содержит дитиоацильную группу.
В латексе неспелых плодов папайи содержатся также ингибиторы протеолитических ферментов: цистатин (ингибитор протеиназ с молекулярной массой 11 262 Да) и белок со свойствами ингибитора цистеиновых протеиназ, молекула которого состоит из 184 аминокислотных остатков, содержит 2 дисульфидные связи и 2 углеводных остатка в позициях Asp84 и Asp90 (Odani S. etc., 1996) [2–4, 12–19].
В спелых плодах дынного дерева содержится 8–12 % сахара, значительное количество витаминов А, В1, В2, С и D, тонизирующие вещества. В листьях папайи выявлены свободные и связанные фенольные соединения, танины, органические кислоты и алкалоиды.
В листьях имеются свободные и связанные фенольные соединения, танины, органические кислоты, стероидные и тритерпеновые сапонины, флавониды, липиды, кумарины, глюкозы, альколоиды, применяемые при лечении туберкулеза и обладающие желче- и мочегонными свойствами [2–4, 11–20].
Фармакологические свойства. Эти протеолитические ферменты растительного происхождения обладают противовоспалительными, антикоголяционными, диградрационными, болеутоляющими, бактерицидными, гемолитивными свойствами. Данные ферменты широко применяются в медицинской практике: офтомологии, хирургии, нейрохирургии, ортопедии, урологии, гастроэнтрологии и др. Они способствуют разрушать белки полупепдидов и аминокислот, растворяют мертвые клетки, при этом не влияя на нормальные.
Модификация комплекса протеиназ папайи синтетическими полимерами. Изучение деструкции ферментных препаратов
Проблема повышения эффективности терапии во многом решается благодаря поиску новых лекарственных средств, важное место среди которых отводится модифицированным производным биокатализаторов с пролонгированным терапевтическим действием [6–8]. Как правило, модификацию ферментов выполняют с использованием растворимых полимеров. В Институте молекулярной биологии и биологической физики АН Грузинской ССР получены водорастворимые и биосовместимые производные полиуретанов и полиамидов [6]. Ранее уже была показана их пригодность для использования в качестве стабилизирующих фермент (трипсин, химотрипсин) носителей [12]. В настоящей работе изучена модификация этими полимерами терапевтически значимого ферментного препарата – комплекса протеиназ папайи [12, 13].
С целью определения целесообразности дальнейшего медико-биологического испытания модифицированных ферментов проведено сравнительное изучение их деструкции под действием экстремальных рН и протеаз. Сопоставление данных о целостности набора молекул ферментного препарата (на основе результатов молекулярно-массового распределения и его каталитической активности) позволяет не только оценить влияние носителя на лекарственный агент, но и сформулировать рекомендации для фармакологического исследования модифицированных препаратов биокатализаторов.
В своей научной статье А.В. Максименко, Л.А. Надирашвили, В.В. Абрамова, Г.С. Еркомаишвили, Р.Д. Кацарава, В.П. Торчилин «Модификация комплекса протеиназ папайи синтетическими полимерами. Изучение деструкции ферментных препаратов» проведённых в Институт экспериментальной кардиологии Всесоюзного кардиологического научного центра АМН СССР и Институт фармакохимии имени И.Р. Кутателадзе АН Грузинской ССР, Тбилиси.
В статье авторами описана химическая модификация комплекса протеиназ папайи синтетическими полимерами – полиамидом, полиуретаном. Изучены свойства модифицированных ферментных препаратов: показана их устойчивость к протеолизу при физиологических условиях и деструкция в щелочной области рН. Модификация комплекса протеиназ папайи усиливает влияние цистеина на стабильность модифицированных препаратов. Осаждение их при кислых значениях рН позволяет легко отделять биокатализатор от реакционной смеси. Обсуждаются перспективы дальнейшего исследования полученных производных.
Условия проведения эксперимента
Реагенты. Нативный препарат комплекса протеиназ папайи (КПЛ) из млечного сока дынного дерева был выделен и охарактеризован по описанному методу [6, 7]. Полимерные носители были получены из Института физиологии им. И.С. Бериташвили АН Грузинской ССР. Ими были водорастворимый полиамид с молекулярной массой 50–60 кД.
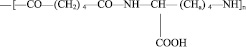 (1)
(1)
и полиуретан с молекулярной массой 45–50 кД [4]
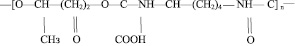 (2)
(2)
Этиловый эфир N-бензол-L-аргинина (ВАЕЕ), L-цистеин, «субтилизин Карлсберг» произведены фирмой Sigma (США). Проназа Е, N-этил-3-(3-диметиламинопропил) карбодиимид, 3-меркапто-1,2-пропандиол – производства фирмы Serva (ФРГ); сефадексG-75 superfine получен от фирмы Pharmacia (Швеция). Все остальные реагенты – продукты производства «Реахим» (СССР) аналитической степени чистоты.
Ковалентное присоединение КПЛ к полимерным носителям. Связывание ферментного препарата с карбоксилсодержащими полимерами проводили через карбодиимидную активацию в соответствии с [8]. 20 мг носителя (полиамида или полиуретана) растворяли в 2 мл 0,01 М раствора трис-буфера, рН 8,0. Затем добавляли 1 мл того же буферного раствора, содержащего 2,5 мг карбодиимида. Смесь инкубировали в течение 30 мин при 4°, после чего добавляли 1 мл раствора того же буфера, содержащего 10 мг нативного КПЛ и 2,5 мг цистеина (для сравнения были выполнены эксперименты и без цистеина в реакционной смеси). Дальнейшую инкубацию проводили в течение 20 ч при 4°. Препараты выделяли методом ультрафильтрации на установке «Amicon» (США) с фильтром ХМ-30, проводя отмывку дистиллированной водой до постоянной оптической плотности промывных вод (220 нм). После этого препараты лиофилизовали. Сравнительное определение молекулярной массы производных проводили методами гель-хроматографии и электрофореза.
Изучение деструкции ферментных препаратов. За деструкцией полимерных образцов cледили, сопоставляя профили элюции проб инкубационной смеси с колонки сефадекса G-75 [9]. Инкубацию препаратов проводили в 0,1 М трис-буфере, рН 7,4 и 0,1 М боратном буфере, рН 9,6, при 30° как в отсутствие, так и в присутствии протеаз – проназы или субтилизина. Концентрация в инкубационной смеси нативного препарата 1 мг/мл, модифицированных – 1–3 мг/мл; проназы 0,2 мг/мл, субтилизина 0,1 мг/мл; носителей (1 мг/мл). Оптическую плотность проб элюата для нативного и модифицированных препаратов регистрировали при 280 нм, для полимерных носителей – при 208 нм.
Определение каталитической активности. Каталитическую активность ферментных препаратов определяли методом измерения начальных скоростей гидролиза 0,05 М раствора ВАЕЕ с 0,1 М КС1 на рН-стате «Radiometer» (Дания) при рН 7,0 и комнатной температуре.
Влияние сульфгидрильных реагентов на каталитическую активность ферментных препаратов исследовали измерением последней до и после (в течение 5 ч) добавления 10 мг/мл меркапто-пропандиола (1 мМ) к растворам биокатализаторов [6].
Измерение термостабильности ферментных препаратов. Растворы нативного и модифицированного полиамидом или полиуретаном (10 мг/мл) комплекса протеиназ папайи инкубировали при 37 °С в 0,1 М буферных растворах, рН 7,4 или рН 9,6, в присутствии 6 мг/мл и в отсутствие цистеина. Периодически отбирали пробы из инкубационной смеси (0,2 мл) и определяли на рН-стате их каталитическую активность, как описано выше.
Титрование сульфгидрильных групп ферментных препаратов. Эксперимент проводили по методу Эллмана [10], как описано ранее [7]. Титрант – 5,5-дитио-бис-2-нитробензойная кислота (получен от фирмы Calbiochem, США), коэффициент экстинкции 13 600 М•см–1 [6, 7, 12. 13].
В результате получены:
Свойства препаратов комплекса протеиназ папайи, модифицированного синтетическими полимерами. В результате ковалентного присоединения КПЛ к полиамиду или полиуретану с носителем связывается около 90 % исходного количества белка (как в присутствии, так и в отсутствие цистеина в инкубационной смеси). Однако проведение модификации в присутствии цистеина обеспечивает получение препаратов с большей величиной остаточной каталитической активности, чем без этой аминокислоты. Так, для препаратов КПЛ-полиамид, полученных с цистеином и без него, остаточная каталитическая активность составляет 70 и 50 %, соответственно, а для КПЛ-поли- уретан – 70 и 20 %. Данные титрования сульфгидрильных групп в ферментных препаратах показывают, что, по-видимому, ковалентного присоединения цистеина к полимерной матрице не происходит (табл. 1). Цистеин способствует только реактивации обратимо инактивированных ферментов [6], повышая, как уже говорилось, остаточную каталитическую активность модифицированных препаратов.
Таблица 1
Каталитические параметры – ферментативного гидролиза ВАЕЕ нативным и модифицированным комплексами протеиназ папайи (0,1 М KCI, рН 7,0, комнатная температура)
|
Препарат |
Остаточная каталитическая активность, % |
Содержание SH-групп |
Kmкаж, мМ |
Kmкаж, мМ xc-1 |
рН опт |
Молекулярная масса, кД |
|
Нативный КПЛ |
100 |
0,92 |
50 |
4,0 |
6,5–7,0 |
20–25 |
|
КПЛ-полиамид |
70 |
0,60 |
2,3 |
2,8 |
6,8–7,5 |
70–80 |
|
КПЛ-полиуретан |
70 |
0,40 |
6,4 |
3,7 |
6,8–7,5 |
60–70 |
Существенного ухудшения каталитических свойств ферментного комплекса модификация не вызывает. рН-оптимум каталитической активности модифицированных биокатализаторов расширяется (табл. 1). Вероятно, его сдвиг в щелочную сторону может быть связан с уменьшением положительного заряда ферментных молекул при модификации [6]. Нативный и модифицированные препараты КПЛ сохраняют способность активироваться под действием сульфгидрильных реагентов (рис. 1). Это свидетельствует о наличии в препаратах доли обратимо инактивированных ферментов и о более мягком воздействии на структуру биокатализаторов их ковалентного присоединения к полиамиду или полиуретану, чем к альдегиддек-странцистеину [6].
Устойчивость модифицированных ферментных препаратов к действию экстремальных рН и протеаз. Представляет интерес изучить устойчивость модифицированных ферментных препаратов в широком интервале рН. Однако модифицированные препараты в области кислотных значений рН (4,5) являются водонерастворимыми в используемых концентрациях. Поэтому мы исследовали устойчивость разных форм КПЛ при рН 7,4 и 9,6. Как уже отмечалось [9], при рН 7,4 происходит ассоциация нативного препарата за счет тиол-дисульфидного взаимодействия (рис. 2, а).
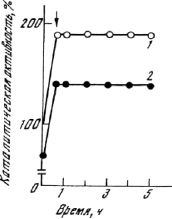
Рис. 1. Влияние 1 мМ меркаптопропандиола (стрелкой показан момент введения этого реагента в инкубационную смесь) на каталитическую активность нативного (1) и модифицированного полиамидом (2) препарата комплекса протеиназ папайи. Условия: рН 7,0, комнатная температура. Аналогичная зависимость имеет место и для препарата КПЛ, модифицированного полиуретаном (не показано). Похожая картина наблюдается и при добавлении цистеина или дитиотреитола
Изменение молекулярно-массового распределения модифицированных препаратов в этих условиях не происходит. При щелочных рН (9,6) стабильность нативного и модифицированного полиуретаном КПЛ приблизительно одинакова. Деструкции подвергается 10–15 % препарата. КПЛ, модифицированный полиамидом, в условиях эксперимента изменений не претерпевает. Деградация полимерных носителей ни при рН 7,4, ни при рН 9,6 не наблюдается.
Присутствие в инкубационной смеси других протеаз (проназы, субтилизина) усиливает деструкцию препаратов (рис. 2).
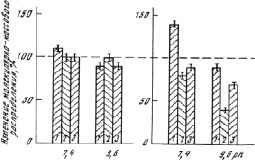
а б
Рис. 2. Изменение молекулярно-массового распределения (см. [9]) ферментных препаратов после трехсуточной инкубации при 37 °С: а – в отсутствие других протеаз; б – в присутствии проиазы (1,2) или субтилизина (1,3); 1 – нативный КПЛ; 2 – КПЛ-полиамид; 3 – КПЛ-полиуретан
При рН 7,4 обнаруживается ассоциация нативного КПЛ [8], деструкция КПЛ, модифицированного полиамидом (15–20 %), и относительная устойчивость препарата КПЛ-полиуретан. При рН 9,6 происходит деструкция всех ферментных производных. Она усиливается в ряду нативный КПЛ < КПЛ-полиуретан < КПЛ-полиамид. В присутствии протеаз сам по себе полиуретан деструкции практически не подвергается, а полиамид оказывается менее устойчивым: при рН 7,4 наблюдается его 10–12 %-ная деградация, а при рН 9,6 – 25–30 %-ная деструкция полимера. Таким образом, ковалентное присоединение КПЛ к синтетическим полимерам способствует сохранению препаратами относительной молекулярной целостности при физиологических условиях и не препятствует их протеолизу в области щелочных рН.
Термостабильность ферментных препаратов. При проведении термоинактивации в отсутствие цистеина в инкубационной смеси модификация вызывает дестабилизацию КПЛ при рН 7,4 и 9,6 (рис. 3, а и б). В присутствии цистеина модифицированные препараты оказываются более стабильными, чем нативный КПЛ (рис. 3, в и г).
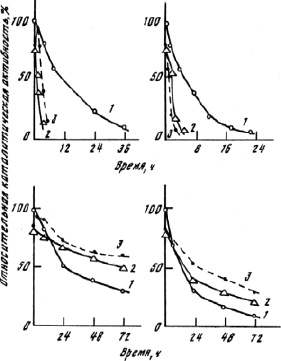
в г
Рис. 3. Кривые термоинактивации ферментных препаратов при 37 °С: а – рН 7,4 (без цистеина); б – рН 9,6 (без цистеина); в – рН 7,4 (в присутствии цистеина); г – рН 9,6 (в присутствии цистеина); 1–3 – как на рис. 2
Сравнение данных рис. 2 и 3 показывает, что не деструкция, а термоинактивация является основной причиной потери активности ферментных препаратов. Это подтверждает сделанный ранее вывод [6, 12, 13], что термостабильность ферментов является ключевым фактором для оценки перспектив их практического использования. Заметно, что модификация комплекса протеиназ папайи усиливает регулирующее влияние цистеина на каталитическую активность модифицированных препаратов. Активирующее влияние цистеина, основанное на тиол–дисульфидном взаимодействии [9], носит обратимый характер. Добавление цистеина к пробе ферментного препарата, инкубируемого без цистеина, позволяет перейти в ходе термоинактивации от кривых рис. 3, а к кривым рис. 3, в. Удаление цистеина диализом из пробы фермента ведет к снижению каталитической активности. Обратимым оказывается и переход осадок € раствор для модифицированных препаратов при изменении рН. Ферментативная активность при этом существенно не меняется. Итак, модификация КПЛ повышает устойчивость препарата к ассоциации в физиологических условиях. Однако полимерный носитель, предотвращая межмолекулярную реакцию тиол–дисульфидного обмена, не препятствует такой внутримолекулярной реакции. Благодаря модификации КПЛ усиливается регуляторное влияние сульфгидрильных реагентов на каталитическую активность и стабильность ферментного препарата. Обратимость его осаждения при кислотных значениях рН (без существенных потерь каталитической активности) позволяет легко отделять биокатализатор от реакционной среды.
На основании полученных данных можно заключить, что модификация комплекса протеиназ папайи синтетическими полимерами позволяет получить стабильные в физиологических условиях ферментные препараты. При щелочных значениях рН они подвергаются заметному протеолитическому расщеплению. Из-за ограниченной растворимости такие препараты, вероятно, пригодны не для внутреннего введения, а для местного и наружного применения. Поэтому полученные производные могут быть рекомендованы для биомедицинских испытаний в таких областях, как травматология и дерматология.
Возможность регуляции каталитической активности модифицированных препаратов сульфгидрильными реагентами и легкость осаждения их при кислотных значениях рН (возможность обратимого отделения) делают перспективным использование таких производных в биотехнологии для получения белковых гидролизатов, синтетических и др. продуктов.
В фармакологической промышленности зарубежных стран выпускается более 100 лекарственных препаратов с использованием млечного сока папайи (лекозим, лекопаин, кариказа, вобензим, суперсжигатель жира № 1 и др.), широко применяемых в различных областях медицины [2–4, 8].
Исходя из этого, учитывая биологические особенности папайи и природно-климатические условия Туркменистана, пришли к выводу о необходимости подбора конструкции теплиц для ее выращивания. Для этого в 1981 году на базе НПО «Солнце» АН ТССР, была сооружена гелиотеплица траншейного типа. Настоящее время выращивание распространилась в Лебапском велаете (области).
Агротехника выращивания и технология получения ферментов. В 1990 году была построена несколько изменённая опытно-промышленная солнечная теплица с комбинированным использованием энергии тепловых отходов Туркменабатского арендного химического предприятия и солнечной энергии. В теплице были высажены 100 дынных деревьев и началось изучение агрометеологических факторов, формирующих микроклимат в сооружении.
С одного плода при двукратной подсочке в месяц добывается 3 грамма латекса, с одного растения из 5 плодов – 15 граммов, что составляет 180 граммов в год с экземпляра. В составе млечного сока содержится; 10 % папаина, 50 % химопапаина, 16 % лизоцима, 24 % протеиназы А и В. С целью повышения добычи фермента с единицы площади плантации можно использовать и черешки листа, где также содержится значительное количество папаина.
По литературным данным существует несколько видов разделения млечного сока папайи. Мы использовали колоночную хроматографию. Разделение проводили при помощи комплекта для хроматографии. Установка включает в себя: градиент; насос; колонку с карбоксиметилцеллюлозой; детектор; коллектор для сбора фракций; самописец.
Следующий этап работы было посвящен получению очищенных препаратов папаина фермента, составляющего около 12 % от всего состава белков.
В процессе работы подобран ионообменник – карбоксиметилцеллюлоза КМ-32. Колонку набивали этим катионообменником. Размеры колонки составляли: высота – 20 см, диаметр – 2,5 см, объем 70 см3.
В качестве буфера использовали Трис – НСI, рН 7.0. Колонку промывали в течение 24 часов. После установления равновесия в колонку вносили 3 мл 10 % раствора млечного сока папайи, предварительно подготовленного и отцентрифугированного в течение 20 минут при 4000 оборотах в минуту. Внесение образца проводили при помощи перестальтического насоса со скоростью 4 мл в час. Элюирование, то есть смывание белков с колонки, проводили 0,05 молярным трисовым буфером рН 7,0. Фракции собирали при помощи автоматического коллектора.
При начальном промывании колонки сходят неактивные соединения. После этого устанавливали градиент концентрации хлористого натрия от 0,1 до 0,5 М. В результате с колонки сошел белок, обладающий протеолитической активностью. Установление градиента концентрации хлористого натрия от 0,5 до 1,0 М позволяло смыть с колонки еще несколько белков. Необходимо отметить, что эти белки при таких условиях не разделялись, а сошли с колонки, налагаясь друг на друга. В дальнейшем проводился подбор условий для разделения химопапаина, лизоцима и протеоназ.
На следующем этапе был проведен электрофоретический анализ полученного белка. Электрофорез занимает центральное место среди методов исследования белков. Этот метод позволяет разделять макромолекулы, различающиеся по таким параметрам, как молекулярная масса, структура и электрический заряд.
В нашей работе использовали пластины полиакриламидного геля, содержащего 15 % акриламида. Электрофорез проводился в кислых условиях, рН разделяющего геля – 4,5, напряжение 250 В, сила тока 45 мА. На электрофореграмме,первым сошел белок с колонки – это папаин. Была определена протеолитическая активность полученного папаина. Она составляет 400 ед./мг белка, это в 2,4 раза выше, чем активность млечного сока папайи [2–4, 8–14].
Применения протеолетических ферментов дынного дерева в медицине
В последнее десятилетие большое внимание уделяется применению протеолитических ферментов в комплексной терапии различных заболеваний. Плоды дынного дерева – сок папайи – используются в народной медицине тропических стран давно.
На Антильских островах сок недозрелых плодов папайи применяют в виде горячих примочек для лечения гнойных ран и различных заболеваний кожи. Американские индейцы уже во времена Колумба знали о лечебных свойствах сока дынного дерева, а его плоды назвали «ванти», что значит «быть здоровым». В индийской фармакопее сообщается, что сок папайи является антигельминтиком.
Мазь, приготовленная из сока дынного дерева, используется в США для лечения изъязвлений, некрозов. В энциклопедическом словаре аптечных работников Советского Союза указывается, что латекс Caricapapaya применяется против глистов и для лечения экземы, гнойных ран, прыщей, бородавок и псориаза. В немецком аптекарском журнале от 1971 г. сообщается, что сок Caricapapaya полезен для лечения гастрита, язвы желудка, хронической диспепсии, ожогов, укусов ядовитых пауков. Некоторые авторы с помощью ферментов этого сока определяли группу крови.
Дынное дерево входит в большое семейство Caricaceja, которое произрастает в тропиках; известны плантации его на Цейлоне, в Восточной Африке, Западной Индии, на Гавайских островах, в Мексике, на юге США. Стебель имеет высоту от 4 до 6 м. Плоды весом от 0,5 до 3 кг, напоминают дыню. Под мягкой корой плода находится мякоть оранжевого цвета, по вкусу похожая на грушу, с запахом дыни. Внутри плода – косточки, внешне похожие на зерна черного перца. У незрелых плодов под корой в многочисленных каналах содержится прозрачная жидкость (латекс), которая на разрезе вытекает и на воздухе быстро мутнеет. Полностью созревшие плоды содержат мало или совсем не содержат латекса.
Экспериментальные исследования L. Thomasa (1956), которыми было доказано хондролитическое действие папаина на пульпозное ядро, позволили L. Smithu (1964) применить его для лечения 10 больных с грыжами поясничных дисков. Спустя 10 лет Wiltsс ообщил о лечении этим препаратом 40 000 пациентов.
Метод внутридискового введения папаина (нуклеолизис) при грыжах поясничных дисков впервые применен в Советском Союзе в 1965 г. в клинике нейрохирургии г. Новокузнецка, руководимый А.И. Осна, а затем в клинике вертебральной хирургии Центрального института травматологии и ортопедии им. Н.Н. Приорова, руководимой А.И. Казьминым. Об эффективности данного метода говорит высокий процент (78–90) отличных и хороших результатов.
В последние годы в Советском Союзе стали использовать протеолитические ферменты сока папайи в офтальмологии и нейрохирургии для предупреждения различных заболеваний глаз и при лечении оптохиазмальных арахноидитов, а также травматического поражения периферических нервов, сопровождающегося рубцово-спаечными изменениями. В клинике Центрального института травматологии и ортопедии им. Н.Н. Приорова разработаны методики лечения папаином различных видов патологии кисти и раневой инфекции. В соответствии с договором о сотрудничестве, заключенным в марте 1976 г. между Управлением по внедрению новых лекарственных средств и медицинской техники Министерства здравоохранения СССР, Министерством здравоохранения Словении и фирмой «ЛЕК» (Любляна, Югославия), был разработан новый препарат протеолитических ферментов дынного дерева, зарегистрированный в декабре 1977 г. под названием Лекозим. Экспериментальные и клинические исследования этого препарата проведены в Центральном институте травматологии и ортопедии им. Н.Н. Приорова, Институте нейрохирургии им. Н.Н. Бурденко, Институте глазных болезней им. Гельмгольца (СССР), в ортопедической клинике г. Любляны (Югославия). После тщательного изучения Лекозима разработаны методики лечения им, которые рекомендуются для применения в медицинской практике [2–5, 8–11, 14].
Химические и физические свойства «Лекозима»
Лекозим – лиофилизированная смесь растительных протеолитических ферментов. Она белого цвета, без запаха и вкуса, хорошо растворимая в воде. Химически Лекозим – 99 % белок, состоящий из папаина (12,4 %), химопапаина (43,5 %), лизоцина (17,4 %) и протеиназы X (26,7 %). Специфическая активность – 6–7 МЕД ед./мг, что соответствует FIP единицам (FIP – Международная фармацевтическая федерация). Известны различия в аминокислотном составе отдельных протеолитических ферментов, входящих в Лекозим. Например, папаин не содержит метионина, в химопапание его очень мало, а в лизоцине много. Во всех ферментах высоко содержание глицина, а химопапаине, в отличие от других двух энзимов, больше лицина. N – терминальная группа папаина – изолейцин, химопапаина – глютаминовая кислота, лизоцина – глицин. Ферменты, входящие в состав Лекозима – основные белки, имеющие изоэлектрическую точку в щелочной области. Приблизительный молекулярный вес папаина – 21.000, химопапаина – 36.000, лизоцима – 25.000. Энзимы эти легко окисляются и связываются с тяжелыми металлами, которые ингибируют их; при температуре более 70 °С они инактивируются. При длительном сохранении в растворенном состоянии теряют активность. Неочищенная смесь стабильная больше года, очищенный препарат менее стабилен. Папаин, химопапаин и протеиназа X – протеолитически активные энзимы, лизоцим-мукополисахарид [5].
Применение Лекозима: в ортопедии
Лечение поясничного остеохондроза методом нуклеолизиса
Показания:
1 – стойкий ирритативный корешковый болевой синдром без органической симптоматики;
2 – длительные боли в пояснично-крестцовой области с органической неврологической симптоматикой (с компрессией корешков);
3 – выраженный стойкий пояснично-крестцовый болевой синдром со сдавлением конского хвоста и нарушением кровообращения вследствие массивного выпадения диска.
Противопоказания. Аллергическое состояние организма; изменения в миокарде после тяжелых инфарктов; наличие задних костных разрастаний тел позвонков; выраженная нестабильность в пораженном позвоночном сегменте; спондилоартоз; эпидурит.
Методика лечения. Под местной анестезией, в ряде случаев под наркозом, в положении больного на боку трансдуральным путем (рис. 4) пунктируют последние 2–3 диска (в зависимости от данных миэлографии), поясничного отдела позвоночника. Для дискографии используется 65 % раствор гепака или верографина, который вводится в объеме 0,6–1,0 мл (до неполного заполнения дисков). Спустя 20–30 мин после дискографии в дегенеративно измененные диски вводят 0,3–0,5 мл 90 % этилового спирта и затем – Лекозим: при дегенеративных изменениях диска без его выпячивания (рис. 5) – в дозе 14 FIP U, при наличии грыжи диска, а также при грыжах диска с черезсвязочным разрывом – от 21 до 35 FIP U, суммарная для 2–3 дисков максимальная доза колеблется в пределах 56–84 FIP U [5, 12–14].
При выраженных дегенеративных изменениях дисков с нарушением целости задней продольной связки и вытеканием контрастного вещества в эпидуральное пространство введение этилового спирта противопоказанно (рис. 6). Этиловый спирт вводится очень медленно, так, чтобы по мере вытекания из иглы он успевал всасыватьcя в ткани диска и не вытекая по игле в полость позвоночного канала, что может быть при быстром введении. По окончании введения в полость дисков этилового спирта и Лекозима иглу уда ляют, за исключением одной, через которую в заднее эпидуральное пространство, в межостистую связку и паравертебрапь – но вводят лекарственную смесь, состоящую из 20 мл 0,5 % раствора новокаина. 1000 мкг витамина В12, 25 мг гидрокортизона и 250 мг кефзола или пенициллина [5–14].
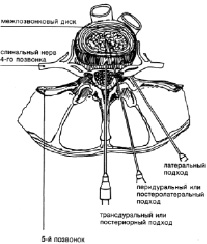
Рис. 4. Доступ для пункции межпозвоночных дисков
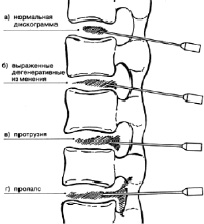
Рис. 5. Нормативные и патологические картины дискографии: а – нормальная дискограмма; б – выраженные изменения диске; в – протрузия диска; г – выпадения диска
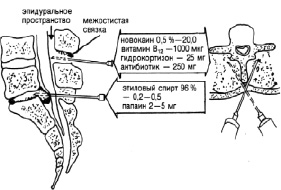
Рис. 6. Схема внутридискового введения Лекозима при воздействии на диск этиловым спиртом (96°) и введении смеси лекарственных веществ. Тактика лечения больного после введения Лекозима
В заднее эпидуральное пространство и межостистую связку вводят по 5 мл смеси, паравертебрально оставшееся количество (рис. 6). Места проколов обрабатываются йодной настойкой; накладывают антисептическую повязку. Больным вводят внутривенно 20 мл 40 % раствора глюкозы и 5 мл 2,4 % раствора эуфиллина, после чего переводят в палату.
В течение 4–5 дней соблюдается постельный режим; со 2-го дня разрешаются активные движения в кровати. В первые 5 дней проводится дегидратационная терапия (внутривенно 20 мл 40 % раствора глюкозы, 5 мл 40 % раствора уротропина). При необходимости применяются обезболивающие средства. На 3–4-е сутки накладывается гипсовый корсет на 1–1,5 месяца. Если остается анталогический наклон туловища, производится вытяжение за тазовый пояс (в течение недели) с грузом 6–8 кг, после чего накладывается гипсовый корсет. Ходьба разрешается на 5–7-е сутки. Больных выписывают из клиники на 2–3-й неделе после лечения Лекозимом. Через месяц гипсовый корсет сменяется полиэтиленовым или корсетом типа Гессинга, в котором больные ходят в течение 1,5 месяца, затем переходят на корсет ленинградского типа. По показаниям некоторым больным сразу после гипсового корсета может быть назначен корсет ленинградского типа. После снятия гипсового корсета больные активно занимаются лечебной гимнастикой, им назначают массаж (для ликвидации неврологической симптоматики), курс медикаментозного лечения (стекловидное тело ежедневно, 30 инъекций, витамин В12 – 500 мкг и витамин В, – 1 мл 6 % раствора – 15, введение с чередованием через день, АТФ ежедневно, 20–25 инъекций). Санаторно-курортное лечение (радоновые и сероводородные ванны) рекомендуются через 2–3 месяца после лечения [2–5, 14].
Побочные явления. В первые сутки после введения Лекозима возможно усиление поясничных болей, увеличение скованности поясничных мышц, поэтому в первые 2–3 дня, наряду с обезболивающими средствами, по показаниям, вводят внутримышечно 2 раза в сутки седуксен по 2 мл. У некоторых больных повышается температура тела до 38–38,5°; в этих случаях рекомендуется внутримышечное введение 5 мл 4 % раствора амидопирина.
Лечение остеохондроза позвоночника методом гальванизации с подкожным введением папаина. При электрофорезе Лекозима препарат почти полностью задерживается в коже, поэтому его предварительно вводят подкожно, а затем с помощью электродов обеспечивают проникновение к патологическому очагу – измененному межпозвоночному диску. Перед внедрением в клинику метод был проверен в эксперименте на животных.
Показания:
1 – распространенный остеохондроз с преобладанием болевого синдрома в грудном и шейном отделах;
2 – упорная люмбалгия, не поддающаяся лечению;
3 – острые ирритативные корешковые боли без неврологической симптоматики.
Противопоказания. Аллергическое состояние организма.
Методика лечения. После обработки кожи антисептическим раствором паравертебрально на расстоянии 0,5–1 см от вершины остистых отроетков тонкой инъекционной иглой подкожно вводится Лекозим в две точки, отстоящие друг от друга на 10–15 см, в одну точку вводится 14–21 FIP U. На эти точки накладываются электроды площадью 100–150 см2 и в течение 20–30 мин проводится гальванизация (плотность тока 10–20 мА/см2), на курс лечения – 10–14 процедур, которые повторяются 2 раза в неделю с двухдневным интервалом. Между процедурами больные получают ручной и подводный массаж, занимаются лечебной гимнастикой. Больным назначаются антигистаминные препараты [2–5, 14].
Побочные явления. В месте введения Лекозима – отек мягких тканей, гиперемия. Эти явления более выражены в области анода. В первые сутки отмечается скованность мышц спины, а также субфебрильная температура.
Применение Лекозима в сочетании с оперативным лечением позвоночника
1. При поясничном остеохондрозе, в случае поражения нескольких дисков с образованием задних грыжевых выпячиваний и наличием псевдоспондилолистеза проводится оперативное лечение из заднего доступа, которое в одних случаях заканчивается удалением грыжы диска на одном уровне и внутридисковым введении на остальных уровнях Лекозима, в других – после скелетирования задних элементов позвоночника – введением фермента в диски на нескольких уровнях. Операции всегда завершаются фиксацией поврежденных сегментов металлической пластинкой Вильсона и заднимспондилодезом. Доза Лекозима, вводимая в один диск, составляет 21–28 FIP U.
2. При сколиозе II и III степени осуществляется химическая деструкция (нуклеолизис) пульпозных ядер на вершине искривления с помощью Лекозима. Такая операция производится как самостоятельная при поясничном сколиозе, так и в сочетании с клиновидной резекцией позвоночника или энуклеацией пульпозных ядер на вершине грудного искривления [5,14].
Методика лечения. После выделения задних элементов позвоночника производится резекция 3–4 ребер на вершине искривления, экзартикуляция головок ребер и пункция обнаженных дисков. В полость диска вводится 21 FIP U Лекозима. При тяжелых формах сколиоза на вершине искривления производится энуклеация пульпозных ядер или клиновидная резекция позвоночника, а в диски, располагающиеся выше и ниже области энуклеации, вводится Лекозим. Операция заканчивается задним спондилозом на стороне вогнутости. После заживления операционной раны (на 12–14-й день) накладывается гипсовый корсет с головдержателем, в котором осуществляется редрессация. Сочетание операции с нуклеолизисом увеличивает мобилизацию позвоночника и позволяет достигнуть в период редрессации дополнительной коррекции основной грудной кривизны позвоночника [14–20].
Лечение раневой инфекции Лекозимом. Использование Лекозима в комплексной терапии раневой инфекции позволяет активно и целенаправленно вмешиваться в течение нагноительных процессов, ускоряя очищение ран от нежизнеспособных тканей. Препарат оказывает также выраженное противовоспалительное и противоотечное действие и повышает эффективность антибиотиков.
Показания:
1 – гнойные и вялозаживающие раны и тропические язвы;
2 – остеомиелит – свищевая форма;
3 – свищи после операций на костях с применением металлических конструкций и эндопротезов;
Противопоказания. Наличие аллергических заболеваний.
Методика лечения ран и свищей. С помощью иглы с тупым концом или постоянного катетера, установленного в полости фистулы, вводится 0,5–1 % раствор Лекозима (содержимое флакона 70 FIP U – 10 мг растворяется соответственно в 2,0 мг или 1,0 мл дистиллированной воды или новокаина). В случаях небольшой свищевой полости концентрация раствора повышается до 2 %. Процедура проводится 2 раза в день.
Как правило, после 2–3 введений гной становится жидким и не задерживается в полости свища; с этого момента вместе с ферментами вводятся антибиотики, а в некоторых случаях – гипериммунная антистафилококковая плазма. Иногда раствор Лекозима с антибиотиками инфильтруется в мягкие ткани вокруг свища [5–7, 14–20].
При лечении ран стерильные марлевые салфетки пропитываются раствором Лекозима и накладываются на рану, в отдельных случаях в промежуток между .салфетками подводится полиэтиленовый катетер, через который раствор фермента вводится 2 раза в день. При глубоком некрозе тканей Лекозиминфильтруется в них. Перевязки делаются через день. Разовая доза Лекозима при лечении ран и свищей – от 20 до 40 мг (140–280 FIP U).
Противопоказано. Применение Лекозима с растворами тяжелых металлов и перекисью водорода, так как они инактивируют фермент.
Побочные явления. Жжение и зуд в области ран в первые часы после применения раствора Лекозима, иногда повышение температуры тела. В таких случаях помогают антигистаминные препараты.
Лечение Лекозимом некоторых заболеваний и последствий повреждений кисти
Показания:
1 – контрактура Дюпюитрена – для лечения начальных ее форм и 1 степени, профилактика контрактуры пальцев кисти, уменьшение сгибательной контрактуры пальцев и улучшение функции кисти и больных с рецидивами заболевания после неоднократных операций, лечение контрактуры Дюпюитрена II и III степени у лиц пожилого возраста, воздерживающихся от операции, преоперационная подготовка больных с контрактурой пальцев II и III степени. При применении Лекозима достигается размягчение мягких тканей и частичное устранение сгибательной контрактуры, что облегчает выполнение оперативного вмешательства, уменьшается число послеоперационных осложнений и улучшаются исходы лечения;
2 – сгибательная контрактура пальцев после сшивания или пластики сухожилий сгибателей пальцев кисти;
3 – стенозирующий лигаментит;
4 – сухожильные ганглии;
5 – тугоподвижность суставов пальцев кисти после длительной иммобилизации или внутрисуставных повреждений.
Противопоказания. Наличие аллергических заболеваний; кожные заболевания кисти. Приготовление препарата. Перед введением препарата содержимое флакона с Лекозимом (70 FIPU) растворяется в 2 мл 2 % раствора новокаина [5, 7, 14–20].
Методика лечения при контрактуре Дюпюитрена и сгибательной контрактуре пальцев
После обработки ладонной поверхности кисти 2 % раствором йода Лекозим вводится в наиболее выраженные узлы и тяжи ладонного апоневроза непосредственно у сухожилий пальцев (рис. 7). Инъекционную иглу проводят сразу через весь участок, в который необходимо ввести Лекозим. Раствор препарата медленно инфильтруется в рубцовые ткани при медленном вытягивании иглы. В случае наличия плотных тяжей, спаянных с окружающими мягкими тканями, раствор Лекозима вводится обычно с большим трудом, поэтому первые две инъекции делаются в окружающие мягкие ткани, спаянные с тяжем, и только после этого – непосредственно в рубцовый тяж. Следует избегать попадания фермента в малоизмененные ткани ладонного апоневроза, так как это вызывает сильный отек мягких тканей кисти.
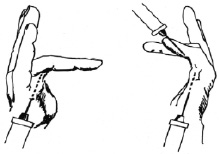
Рис. 7. Схема инфильтрации Лекозима при посттравматических сгибательных контрактур пальцев кисти и при болезни Дюпюитрена
Сразу после инъекции Лекозима накладывается спиртовая повязка, со вторых суток назначаются ванночки с содовым раствором, массаж и редрессирующая гимнастика, на ночь – ладонная шина, фиксирующая пальцы в положении максимального разгибания. Если после первой инъекции появляются признаки общей реакции, применяются антигистаминные препараты. При узелковой форме контрактуры Дюпюитрена разовая доза Лекозима составляет от 7 до 21 FIP (У; курс лечения включает 5–7 инъекций. При контрактуре Дюпюитрена I степени разовая доза составляет 14–35 FIP U, курс лечения – 5–10 инъекций. При контрактуре Дюпюитрена II и III степени разовая доза 21–42 FIP U, в некоторых случаях 56–70 FIP U, на курс лечения 5–15 инъекций. В случае сгибательной контрактуры пальцев, связанной с травмой сухожилий сгибателей, доза препарата такая же, как при контрактуре ДюпюитренаII и III степени. Объем жидкости на одну инъекцию – от 0,6 до 1,2 мл. Лекозим вводится раз в неделю. При небольшой разовой дозе препарата инъекции производятся 2 раза в неделю [14].
Побочные явления. Как правило, спустя 30 мин – 1 час в месте введения препарата появляется зуд, который держится до 2–6 час, у всех больных наблюдается отек мягких тканей кисти и болезненность в области инъекции, выраженность и продолжительность которых зависят от введенной дозы препарата. Повышается температура тела.
Осложнения. При подкожном введении препарата иногда появляются пузырьки с серозно-геморрагическим содержимым, но этого можно избежать, если вводить препарат в рубцово-измененные ткани. У некоторых больных появляется аллергическая реакция, которую можно легко предупредить назначением антигистаминных препаратов (димедрол, пипольфен, супрастин и др.).
Методика лечения стенозирующеголигаментита
После обработки ладонной поверхности антисептическим раствором пальпируется кольцевидная связка или ее узелок. Как правило, при надавливании на кольцевидную связку отмечается резкая болезненность, которая усиливается при попытке согнуть палец. Далее, фиксируя палец в положении разгибания, с помощью тонкой иглы в кольцевидную связку вводится Лекозим. На рис. 8 показаны места расположения кольцевидных связок и точки введения препарата [5, 14].
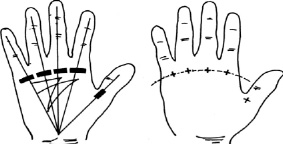
Рис. 8. Места введения микродоз Лекозима в кольцевидные связки при стенозирующем лигаментите
Препарат вводится 1–2 раза в неделю с интервалом в 3–4 дня и с учетом реактивности организма. В перерывах между инъекциями делаются теплые ванночки и легкий массаж кисти и предплечья. Эффект достигается при введении в кольцевидную связку микродозы Лекозима – 1–3 FIP U, иногда 7 FIP U. На курс лечения 5–7 инъекций.
Побочные явления. Незначительный отек мягких тканей в течение 1–1,5 суток, в зависимости от разовой дозы препарата, у некоторых больных – субфебрильная температура.
Лечение сухожильных ганглиев
Лекозим вводится в область ганглия. При расположении последнего по ладонной поверхности полное размягчение наступает после 4–5 инъекций энзима в дозе 3–7 FIP U, при сухожильных ганглиях в области тыла кисти или лучезапястного сустава эффект достигается после 6–8 введений препарата. Обычно после второй инъекции отмечается уменьшение ганглия и разжижение его содержимого, которое свободно отсасывается шприцом. Одноразовая доза 21–35 FIP U. После инъекции накладывается спиртовая повязка [5, 12–14].
Побочные явления. Отек мягких тканей, иногда субфебрильная температура.
Лечение тугоподвижности суставов пальцев кисти
Лекозим вводится внутрисуставно и параартикулярно, внутрисуставно – 1–2 раза в начале и в середине курса; в промежутках между ними препарат вводится в область боковых связок по обе стороны сустава. Одноразовая доза Лекозима при введении в полость сустава 1–3 FIP U, парартикулярно – по 2–3 FIP U с каждой стороны, на курс лечения 5–7 инъекций. Со вторых суток больным назначаются теплые ванночки и лечебная гимнастика.
Побочные явления. Отек мягких тканей, болезненность, у некоторых больных субфебрильная температура.
Нейрохирургия
Показания:
1 – Базальные арахноидиты (воспалительные, травматические), в том числе опто-хиазмальные арахноидиты;
2 – Остаточные явления травмы периферических нервов с наличием рубцово-спаечных изменений.
Противопоказания абсолютные. Острая стадия или стадия обострения вышеуказанных заболеваний, сопутствующие воспалительные и инфекционные заболевания. Амавроз любой этиологии, опухоли головного мозга.
Противопоказания относительные. Повышенная чувствительность к Лекозиму.
Меры предупреждения осложнений, возникших в результате повышенной чувствительности к Лекозиму. Антигистаминная терапия (тавегил, супрастин, диазолин) по 1 таблетке 2–3 раза в день.
Методика применения «Лекозима»
В клинической нейрохирургической практике чаще других применяется электрофорез Лекозима. Используется раствор препарата с рН 6. Это достигается добавлением во флакон 2 мл бидистиллированной воды. Раствором смачивается фильтровальная бумага, сверх которой помещается влажная прокладка, подогретая до температуры 36–40 °С, а затем электрод. Препарат вводится с анода. Доза препарата различная: в зависимости от способа электрофореза и характера заболевания.
1. При интраназальном электрофорезе лечение базальных арахноидитов начинают с дозы 17,5 FIP U и при отсутствии явлений раздражения слизистых носовых ходов через 3–5 процедур переходят к дозе 35 FIP U. Сила тока – 0,5–2 тА, продолжительность процедуры – 20 мин. Курс состоит из 18–25 процедур. Количество курсов 2–3. Интервалы между курсами: 3–5 месяцев. Желательно сочетание физиотерапии с курсом сосудо-расширяющих препаратов – эуфиллином, дибазолом, но-шпа, галидором по общепринятой схеме.
2. При электрофорезе через кожу начинают с 35 FIP U и через 5–6 процедур при отсутствии выраженной реакции кожи переходят на 70 FIP U. Сила тока – 2–10 мА, продолжительность процедуры – 20 мин, курс состоит из 20 процедур. Повторность курсов через 3–6 месяцев, количество курсов: 3–4 [5–11, 14–20].
Расположение и площадь электров:
1 – При интраназальной методике – в каждую ноздрю вводят освобожденный на расстоянии 2–2,5 см от изоляции и опаянный конец провода, плотно обернутый слоем ваты, смоченный раствором Лекозима. Оба провода присоединяются к одному полюсу аппарата (анод). Второй электрод размером 8/10 или 5/10 см при соединении его с катодом помещают в области нижних шейных позвонков.
2 – Электрофорез на области конечностей – по общепринятым методикам, продольно или поперечно, в зависимости от места применения.
Схема – Количество раствора, наносимого на прокладку (фильтровальную бумагу) зависит от активности препарата во флаконе (в каждый флакон вводится 2 мл бидистиллированной воды) (табл. 2).
Таблица 2
|
Сколько единиц надо ввести больному |
Сколько мл раствора взять |
|
35 FIP U |
1 мл |
|
70 FIP U |
2 мл |
Офтальмология
Показания к применению:
- вялотекущие кератиты и помутнения роговицы;
- келлоидные рубцы конъюнктивы и кожи век;
- вялотекущие увеиты;
- хрусталиковые массы после травмы и экстракции катаракты;
- адгезивные процессы после операций и травм;
- кровоизлияния в оболочки и среды глаза.
Способы введения:
- электрофорез вводится по двум методикам: через ванночку и эндоназально;
- фонорез по двум методикам: контактная, через ванночку;
- форсированная инстиляция
Методика введения. Для электро- и фонофореза содержимое флакона с активностью 35 FIPU Лекозима разводят 2 мл дистиллированной воды с добавлением 8 мл физиологического раствора. На одну процедуру берется 5 мл приготовленного раствора. рН – около 6. Температура раствора – 36–40 °С. Лекозим вводится с анода. Сила тока 0,5–1,5 мА. Продолжительность процедуры – 10–15 мин, при эндоназальной методике – до 20 мин. При фонофорезе интенсивность озвучивания – 0,3 Вт/см2, частота ультразвуковых колебаний – 2640 кГц, продолжительность сеанса 5 мин. Курс лечения состоит из 10–15 процедур, проводимых ежедневно. При наличии спаечного процесса лучший результат достигается в тех случаях, когда через 2–3 часа после электрофореза проводится субконъюнктивальная инъекция мидриатических средств [2, 3, 5–11].
Форсированные инстиляции особенно часто используются в детской практике. В связи с возрастом ребенка, его психофизическим состоянием бывает невозможно или резко затруднено проведение физиотерапевтических процедур или инъекций, а также потому, что проведение этих методов введения препарата бывает нецелесообразно в ранние сроки после операции. Инстилляции Лекозима назначаются довольно рано в послеоперационном периоде, начиная с 4-го до 8-го дня после операции. Инстилляции проводятся каждые 5–10 мин в течение часа, 3–4 раза в день (в течение 10–30 дней). Еще более выраженный рассасывающий эффект отмечается от применения комбинации инстилляции Лекозима с физиотерапевтическими процедурами, и инъекциями кислорода под конъюнктиву, которые подключаются к лечению на 6-й и 11-й день после начала инстилляции.
Противопоказания: острые воспалительные процессы глаза.
Побочные явления. Переносимость электро- и фонофореза, как правило, хорошая. У некоторых пациентов могут появиться зуд и гиперемия конъюнктивы глазного яблока. Эти явления быстро купируются инстилляциями в конъюнктивальный мешок 2 % раствора хлористого кальция или добавлением его в ванночку при проведении процедуры. Переносимость инстилляции Лекозима хорошая без побочных явлений.
 science-review.ru
science-review.ru