Известна противоречивая роль Helicobacter pylori в ульцерогенезе [1–2]. Многие авторы признают ее главную роль в возникновении и агрессивном течении язвенной болезни и более частых рецидивах язв как желудочной, так и дуоденальной локализации, функциональной диспепсии [3–4], ишемической болезни сердца и атеросклероза [5–10], рака желудка [11–14], гастрита и дуоденита [14–15], железодефицитной анемии [16], некоторых неврологических заболеваний, включая инсульт, болезни Альцгеймера и Паркинсона [17–19], а также синдрома Рейно, ревматоидного артрита, тиреоидита Хашимото, синдрома Шегрена, атопического дерматита, бронхиальной астмы, пищевой аллергии, дерматологических заболеваний, алопеции, бесплодии, глаукоме, бронхите, мигрени [20]. Возникновение и прогрессирование расстройств пищеварения, послеоперационных патологических синдромов, а также характер ближайшего и отдаленного результата также связывают с инфицированностью слизистой резецированного желудка [1–2, 21–22]. Вместе с тем ряд авторов отрицают связь инфицированности HP с ГЭРБ, в том числе и с рефлюксной болезнью оперированного желудка [23–24] и, соответственно, необходимость проведения эрадикации Helicobacter pylori.
Антихеликобактерная терапия служит самым надежным способом уменьшения распространенности рака желудка, восстанавливая измененную слизистую желудка до нормального состояния при отсутствии предраковых изменений. Однако явления кишечной метаплазии на фоне антихеликобактерной терапии не регрессируют [15, 25–26].
Диагностика инфекции Helicobacter pylori нередко представляет определенную трудность для клиницистов [27–28]. Это особенно актуально при назначении нестроидных противовопалительных препаратов, антикоагулянтов и дезагрегантов у полиморбидных пациентов с противопоказаниями для проведения инвазивных методов диагностики Hp [28–29].
Наиболее распространенным способом для диагностики Helicobacter pylori в настоящее время является применение серологических методов [30]. Установлено, что результаты применения тест-систем могут давать значимые колебания в различных регионах из-за антигенной композиции штаммов Helicobacter pylori. В связи с этим диагностические тест-системы должны быть предварительно откалиброваны для каждой географической зоны и только после этого предлагаться к применению [30]. Для повышения качества диагностики показано прекращение терапии ингибиторами протонной помпы за 2 недели, а антибактериальных препаратов и препаратов висмута – за 4 недели перед диагностикой Helicobacter pylori [31]. Иначе возможна негативная фальсификация результатов в связи с применением указанных препаратов [32].
В клинической практике, еще одним распространенным способом является уреазный тест в биоптате, чувствительность и специфичность которого превышает 90 % [21–22]. Одним из способов диагностики в качестве серологической биопсии у пациентов с симптомами диспепсии является также определение пепсиногенов, гастрина-17 и Helicobacter pylori [31–33].
В последние годы частота успешной эрадикации Helicobacter pylori при применении существующих схем лечения продолжает снижаться. Результаты последних исследований подтверждают факт, что стандартная тройная терапия становится неэффективным методом эрадикации Helicobacter pylori в связи с увеличением количества резистентных штаммов Helicobacter pylori как в разных странах, так в отдельных регионах в пределах одной страны. Таким образом, становится актуальным проведение исследований по изучению региональных особенностей устойчивости Helicobacter pylori к определенным антибактериальным препаратам с последующей разработкой схем эрадикационной терапии, эффективных в том или ином регионе, но по-прежнему остается эффективной квадротерапия с препаратом висмута, позволяющая достичь хороших результатов. В настоящее время эта схема позволяет достичь хороших результатов при проведении эрадикации Helicobacter pylori [34].
Учитывая увеличение антибиотикрезистентных штаммов Helicobacter pylori с целью повышения эффективности терапии, предотвращения дальнейшего роста резистентности (в том числе к макролидам) необходимо накопление российских данных о применении и эффективности различных схем эрадикации [35].
Установлено, что эрадикация Helicobacter pylori достоверно снижает риск развития рака желудка [36–37], что ставит ее к способам канцерпревенции [38]. Если отсутствуют явления кишечной метаплазии эрадикация Helicobacter pylori приводит к регрессу атрофии слизистой оболочки желудка, предотвращает прогрессирование предраковых состояний в неопластические процессы [11]. У НПВП-пользователей эрадикация Helicobacter pylori может рассматриваться как эффективная стратегия первичной профилактики язвообразования и язвенных кровотечений [36, 39].
Установлено, что после резекции желудка возникает ряд факторов, влияющих на развитие послеоперационного рефлюкс-гастрита: состояние анастомоза [38], моторно-эвакуаторная дисфункция резецированного желудка, дистрофические и воспалительные изменения в области анастомоза [39], отсутствие пилорического жома, функциональное состояние двенадцатиперстной кишки и её органические заболевания [40–41], наличие дренирующих желудок соустий и др.
Доказано, что развитие рефлюкс-гастрита с большей вероятностью прогнозируется на фоне предшествующих операций изменений слизистой оболочки, недостаточности кардии [21–22, 27]. При формировании поверхностного гастрита нарушаются моторная и эвакуаторная функции желудка, которые в последующем способствуют развитию таких болезней оперированного желудка как демпинг-синдром, синдром приводящей петли [40–43].
Частота послеоперационного рефлюкс-гастрита различна и зависит от выполненной методики операции. Наиболее выраженный рефлюкс-гастрит отмечается после формирования гастроэнтероанастомоза по Бильрот II [1–2, 21–22]. Поэтому, при высокой вероятности развития рефлюкс-гастрита рекомендуется выполнение резекций желудка с арефлюксными анастомозами [44].
При проведении курса консервативной терапии наступало значительное улучшение в общем состоянии больных с сохранением трудоспособности при назначении дробного питания с ограничением желчегонных продуктов, антацидов, антихеликобактерных препаратов, средств, стимулирующих регенерацию слизистой желудка, седативных препаратов, средств, регулирующих моторно-эвакуаторную функцию желудка и кишечника, лечебной физкультуры [39, 45].
В развитии послеоперационного рефлюкс-гастрита имеют значение и нарушения секреторной функции желудка. Изучение Helicobacter pylori после резекции желудка свидетельствует о том, что у большинства больных сохраняется персистенция Helicobacter pylori, но частота выявляемости не зависит от способа хирургического лечения. Персистенция Helicobacter pylori чаще отмечена у больных с нарушенной кислотообразующей функцией желудка. Определённая зависимость наблюдается между Helicobacter pylori и воспалением слизистой желудка [35, 46].
Цель исследования – изучить особенности инфицированности Helicobacter pylori у больных язвенной болезнью, после различных способов резекции желудка и на фоне дуоденогастрального рефлюкса.
Материалы и методы исследования
На наличие Helicobacter pylori обследованы 38 пациентов, из которых 20 – с гастральной язвой и 18 – дуоденальной язвой. Продолжительность противоязвенной терапии была не менее трех недель, включая антисекреторную терапию, 18 пациентам лечение было дополнено эрадикационной терапией.
Верификация Helicobacter pylori осуществлялась быстрым уреазным тестом в биоптатах слизистой оболочки с одновременным проведением бактериоскопической верификации микроорганизма. Изменение цвета среды фиксировали через 30 минут инкубации: желтый цвет указывал на отсутствие инфицированности (отрицательная реакция), а розовое или красное окрашивание свидетельствовало о наличии инфицированности (положительная реакция).
Степень выраженности ферментативных свойств по уреазному тесту оценивали по шкале: «–» – отрицательная реакция; «+» (слабоположительный) – реакция до 24 часов, «+ +» (положительный) – реакция до 2 часов, «+++» (резко положительный) – реакция в течение 30 минут. Морфологические свойства и подвижность Helicobacter pylori оценивали по мазкам-отпечаткам, окрашенным по Граму.
Тесты на Helicobacter pylori в биоптатах слизистой оболочки проведены как до лечения, так и через 23–43 недели после завершения консервативной терапии. Helicobacter pylori был обнаружен в биоптатах слизистой оболочки до начала лечения у всех пациентов. Уреазный тест был разной степени выраженности.
Результаты исследования и их обсуждение
В контрольной группе рубцевание язвенного дефекта наблюдалось на 19,0 ± 2,3 день, а в группе сравнения – на 16,1 ± 1,6. При эрадикационной терапии выявлено отсутствие Helicobacter pylori у всех пациентов. В то же время антисекреторная терапия ингибиторами протонной помпы не позволила ликвидировать инфицированность Helicobacter pylori. Стойкий лечебный эффект свыше 2 лет отмечался в группе больных, получивших как базисную антисекреторную, так и эрадикационную терапию. Однако по истечении 2 лет частота реинфицирования Helicobacter pylori вновь возрастает.
Оценка ферментативных свойств Helicobacter pylori показала наличие хеликобактериоз-ассоциированной язвенной болезни у 89,5 % больных (рисунок). При медиогастральных язвах желудка Helicobacter pylori обнаружены у 86,7 %, при сочетании дуоденальной и гастральной язв – у 90,0 %, при препилорических и пилорических язвах – у 92,3 % обследованных. Различия в частоте инфицированности были несущественными и могут быть объяснены лишь различиями в уровне секреции и частоте дуоденогастрального рефлюкса. Рефлюкс желчи неблагоприятно влияет на условия жизнедеятельности Helicobacter pylori в антральном отделе и способствует миграции их в тело желудка, где более кислая среда. Аналогичного мнения придерживается S. Khulusi et al., (1995), считающий, что интрагастральное повышение содержания желчных кислот способствует снижению Нelicobacter pylori.
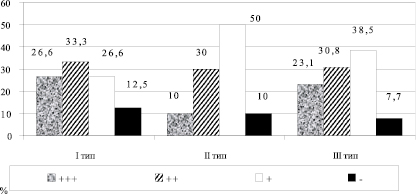
Выраженность уреазного теста при язвенной болезни I–III типов
Персистенция Helicobacter pylori в культе резецированного желудка обнаружена у 76,3 % больных. После резекции желудка по Бильрот-I персистенция отмечена в 1,24 раза реже, чем после резекции желудка по Бильрот-II. В отличие от неоперированного желудка частота инфицированности слизистой резецированного желудка была выше при наличии сопутствующего дуоденогастрального рефлюкса. После привратниксохраняющей резекции Helicobacter pylori обнаружены практически у всех обследованных. Мы связываем это с сохранением участка препилорического отдела желудка – излюбленного места локализации Helicobacter pylori. Кроме того, сохранение препилорического отдела желудка способствует сохранению умеренной желудочной секреции, что также является определенным фоном для персистенции Helicobacter pylori в области тела и дистальной части культи желудка.
При сравнительной оценке инфицированности культи желудка путем исследования биоптатов слизистой из тела желудка и антрума установлена возможность «миграции» Helicobacter pylori из антрума в область тела на фоне снижения выработки хлористоводородной кислоты и повышения секреции кислотонейтрализующих факторов в антральном отделе. Такая особенность отмечается как на фоне медикаментозной терапии, так и хирургического лечения. Объясняется это тем, что оптимальной для Helicobacter pylori считается среда, характеризующаяся равновесием между факторами «агрессии» и «защиты» в желудочном соке (рН = 3,0–3,5).
Таким образом, высокая степень инфицированности слизистой культи резецированного желудка [47] требует проведения специфической эрадикационной терапии [48]. Частота персистенции Helicobacter pylori в слизистой культи желудка сопряжена со способом и объемом резекции, хотя некоторые авторы не нашли этому подтверждение. Установлено, что сохранение инфицированности культи желудка у пациентов, оперированных по поводу доброкачественных заболеваний, в дальнейшем может привести в развитию рака желудка [49–50]. В связи с этим эрадикационная терапия показана пациентам с хеликобактериоз-ассоциированной язвенной болезнью не только в качестве медикаментозной терапии, предоперационной подготовки, но и в послеоперационном периоде.
Библиографическая ссылка
Давыдкина М.А., Пигачев А.В., Чапаев Н.А., Беляева Н.А. ХЕЛИКОБАКТЕРИОЗ ОПЕРИРОВАННОГО ЖЕЛУДКА // Научное обозрение. Медицинские науки. 2017. № 6. С. 24-28;URL: https://science-medicine.ru/ru/article/view?id=1043 (дата обращения: 03.03.2026).
 science-review.ru
science-review.ru