Одна из распространенных причин снижения качества жизни в настоящее время – проблемы с кровоснабжением и кровообращением нижних конечности. Одна из причин нарушений нормального кровообращения нижних конечностей – гиподинамия и офисная работа. Всемирная организация здравоохранения (ВОЗ) активно следит за статистикой возникновения и течения заболеваний системы кровообращения, по данным ВОЗ варикозное расширение вен – одно из самых распространённых заболеваний вен нижних конечностей [1, 2].
Препараты флебопротекторного действия широко представлены на международном фармацевтическом рынке. При этом доминируют лекарственные препараты, созданные на базе флавоноидов и флавоноидных комплексов, в основном диосмина и гесперидина. Базисным фармакологическим действием диосмина является капилляропротективное. Наиболее эффективным сочетанием для укрепления сосудистой стенки является сочетание двух флавоноидов – диосмина и гесперидина. Во многих исследованиях комбинация этих двух соединений обеспечивает повышение тонуса вен и уменьшение их растяжимости, повышение капиллярной проницаемости, укрепление капиллярной стенки, ограничение травматизации капилляров и вен, препятствование застою крови в венах и развитию на почве этого трофических язв [3, 4].
Целью исследования является разработка оптимальных составов, технологические исследования наружных мягких лекарственных форм с флавоноидной микронизированной фракцией (диосмин + гесперидин) с пенетрирующим эффектом.
Материалы и методы исследования
В качестве действующего вещества была выбрана очищенная микронизированная флавоноидная фракция (диосмин + флавоноиды в пересчете на геспередин).
Для оптимальной мазевой основы выбраны следующие компоненты: ланолин безводный, лецитин, карбопол, вода очищенная, раствор NaOH 10 %, масло подсолнечное, аэросил, ПЭГ 400, ПЭГ 1500. Все используемые компоненты соответствовали всем требованиям нормативной документации.
Для исследования высвобождения из мазевых основ флавоноидной микронизированной фракции использовали метод диффузии в желатиновый гель с соответствующими качественными реактивами на флавоноиды. Также для анализа на высвобождение флавоноидов использовали метод диализа, оптическую плотность диффундирующих в диализную среду флавоноидов затем определяли спектрофотометрически на спектрофотометре СФ 102 «Аквилон».
Результаты исследования и их обсуждение
При разработке композиционного состава мягкой лекарственной формы важно учитывать, что тщательный подбор компонентов основы мази будет напрямую влиять на высвобождение действующих веществ лекарственной формы и, следовательно, на степень проявления терапевтического эффекта. При подборе оптимального основообразующего компонента мази учитывали свойства действующего вещества – флавоноидной микронизированной фракции. Для разработки композиций мазей использовали популярные мазевые основы разной степени липофильности и гидрофильности.
Проведены биофармацевтические исследования по определению целесообразной концентрации флавоноидной микронизированной фракции, состава, технологии производства мази флебопротекторного действия.
Приготовлено четыре образца мази с концентрацией от 0,1 до 2 %.
Для проведения биофармацевтических исследований по анализу высвобождения действующих компонентов из мазевой композиции использовали in vitro методики: метод «колодца» при непосредственном помещении навески мази в лунку желатинового геля, содержащего в себе специфический реактив на высвободившийся компонент. Наиболее целесообразная концентрация флавоноидной микронизированной фракции составила 2 %.
Большое значение при подборе мазевых композиций при дизайне состава и технологии производства мази отдают выбору оптимальной мазевой основы, благодаря которой высвобождение действующих веществ будет максимально возможным. Флавоноиды – соединения в основном липофильного характера, исходя из свойств действующих веществ, из всего спектра доступных основообразующих компонентов выбирали мазевые основы преимущественно дифильного характера. Составы мазевых композиций с очищенной микронизированной флавоноидной фракцией представлены в табл. 1.
Таблица 1
Составы мазевых композиций с очищенной микронизированной флавоноидной фракцией (в пересчете на 100,0 г мази)
|
Составляющие мазевой композиции |
Номер композиции мази |
|||
|
1 |
2 |
3 |
4 |
|
|
Ланолин безводный, г |
56 |
1 |
||
|
Лецитин, г |
30 |
|||
|
Карбопол 940, г |
||||
|
Вода очищенная, мл |
12 |
94 |
||
|
Раствор NaOH 10 %, мл |
3 |
|||
|
Масло подсолнечное, г |
88 |
|||
|
Аэросил, г |
10 |
|||
|
ПЭГ 400, г |
68,6 |
|||
|
ПЭГ 1500, г |
29,4 |
|||
|
Флавоноидная микронизированная фракция (диосмин + флавоноиды в пересчете на геспередин), г |
2 |
2 |
2 |
2 |
Подбор оптимальной основы мази проводили, оценивая степень диффундирования действующего вещества и компонентов основы в желатиновый гель, содержащий железа хлорид (III) (качественный реактив на фенольные гидроксилы, содержащиеся в флавоноидах) и алюминия хлорид (качественный реактив на флавоноиды). Через 3, 10 и 24 ч проводили замер диаметра окрашенных зон диффузии каждой мази (рис. 1). Полученные результаты отражены в табл. 2 [5, 6].
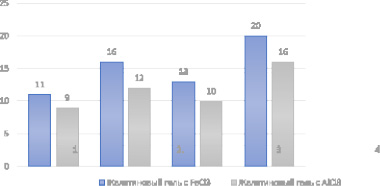
Рис. 1. Результаты биофармацевтической оценки степени высвобождения действующих веществ
Таблица 2
Влияние различных мазевых основ на степень высвобождения флавоноидной микронизированной фракции
|
Номер мазевой основы |
Радиус окрашенных зон, мм |
|||||
|
3 ч |
10 ч |
24 ч |
||||
|
Железа хлорид (III) |
Алюминия хлорид |
Железа хлорид (III) |
Алюминия хлорид |
Железа хлорид (III) |
Алюминия хлорид |
|
|
1 |
0 |
0 |
5 ± 0,01 |
3 ± 0,01 |
11 ± 0,01 |
9 ± 0,01 |
|
2 |
2 ± 0,02 |
3 ± 0,01 |
10 ± 0,01 |
10 ± 0,02 |
16 ± 0,01 |
12 ± 0,03 |
|
3 |
3 ± 0,01 |
3 ± 0,02 |
8 ± 0,01 |
4 ± 0,01 |
13 ± 0,03 |
10 ± 0,01 |
|
4 |
4 ± 0,01 |
0 ± 0,01 |
14 ± 0,01 |
10 ± 0,01 |
20 ± 0,01 |
16 ± 0,02 |
Анализ полученных результатов показал, что наибольшее высвобождение флавоноидной микронизированной фракции обеспечивала мазевая основа № 4 (ПЭГ-400 (7 ч.): ПЭГ-1500 (3 ч.).
Анализ высвобождения флавоноидов проводили для мазевой композиции «ПЭГ400 – ПЭГ1500 (7:3)» через полупроницаемую мембрану. Выбор диализной среды анализируемых мазевых композиций зависел от физико-химических свойств диосмина. Диосмин нерастворим в воде и этиловом спирте, но растворим в растворах натрия гидроксида различных концентраций. Такое свойство диосмина обусловлено способностью фенольных гидроксидов диосмина ионизироваться и образовывать соли – феноляты. В связи с этим в качестве диализной среды использовали раствор натрия гидроксида концентрации 0,02 моль/л [7].
Эксперимент проходил при температуре 37 °С. В качестве диализатора использовали диализаторную трубку диаметром 30 мм, на которую фиксировали полупроницаемую мембрану – целлюлозную пленку («Купрофан», диаметр пор 0,2 мм). Пробы для анализа отбирали через каждые 15 мин от начала постановки эксперимента (т.е. на 15, 30, 45, 60, 75 и 90 минуте). Объем диализной среды восполнялся сразу после забора проб для анализа. Количественное определение диосмина проводили спектрофотометрически, при аналитической длине волны 370 нм. Для расчёта концентрации диосмина использовали СО диосмина. Для этого готовили раствор СО диосмина (производитель «Сигма», чистота 95 %) в 0,02 моль/л NaOH, точную навеску диосмина (0,0110) растворяли в мерной колбе на 25,0 мл, из этой колбы отбирали аликвоту 1,0 мл и разводили еще раз в мерной колбе на 25,0 мл. Затем измеряли оптическую плотность полученного раствора и испытуемых (при необходимости производили разведение испытуемых растворов, учитывая при расчетах) при 370 нм, по полученным данным выводили формулу и измеряли процентное содержание диосмина в забранной диализной среде [8, 9].
Расчет высвобождения диосмина проводили по формуле
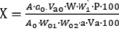 ,
,
где A – оптическая плотность диосмина в анализируемой диализной среде; a – исходная навеска диосмина, содержащаяся в 5,0 г мази, г; a0 – навеска СО диосмина, г; Va – объем аликвоты диализной среды, мл; Va0 – объем аликвоты СО диосмина, мл; W`1 – объем мерной колбы, используемой для разведения испытуемых растворов, мл; W – объем диализной среды высвобождения; Р – содержание диосмина в СО (95 %); A0 – оптическая плотность раствора СО диосмина в 0,02 моль/л NaOH; a – исходная навеска диосмина, содержащаяся в 5,0 г мази, г; W01, W02 – объемы мерных колб, используемые для приготовления раствора СО диосмина.
Максимальное высвобождение диосмина на 15-й минуте наблюдалось из мазевой композиции «ПЭГ400 – ПЭГ1500 (7:3)». Содержание диосмина составило 35,9 %. В целом высвобождение диосмина из мазевых основ было равномерным по времени (рис. 2). Максимум высвобождения из мазевой композиции был зафиксирован на 90-й минуте. Полученные результаты отражены в табл. 3.
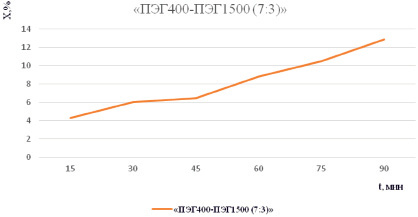
Рис. 2. Зависимость высвобождения диосмина в диализную среду в зависимости от времени
Таблица 3
Значение оптической плотности и количественное содержание диосмина, перешедшего в диализную среду, в %
|
t* Мазевые композиции |
15` |
30` |
45` |
60` |
75` |
90` |
|
|
«ПЭГ400 – ПЭГ1500 (7:3)» |
Оптическая плотность |
0,432 |
0,512 |
0,558 |
0,602 |
0,708 |
0,778 |
|
% |
35,9 |
42,5 |
46,32 |
49,97 |
58,77 |
64,58 |
|
t* – время забора пробы.
На основании представленных данных была составлена технологическая схема приготовления мази с флавоноидной микронизированной фракцией на основе ПЭГ400:ПЭГ1500 (рис. 3). При точном соблюдении приведенной технологической схемы была приготовлена серия мазей и установлены нормы качества разработанной мази. Также были установлены критические моменты приготовления мази, на которые необходимо обращать особое внимание, в данной технологической схеме это гомогенизация мази, этот этап необходимо проводить очень тщательно, чтобы не допустить расслаивания мази и нарушения ее стабильности.
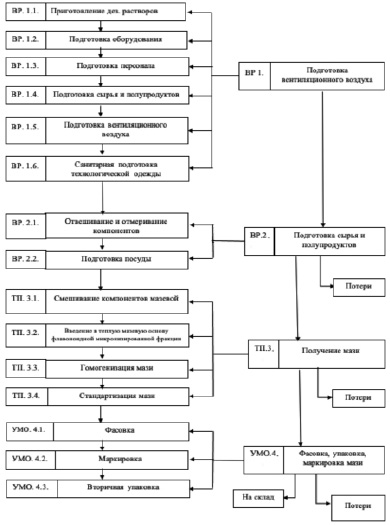
Рис. 3. Технологическая схема получения мази флебопротекторного действия на гидрофильной основе
Описание внешнего вида мази: имеет вид пластичной, однородной массы желто-оранжевых оттенков, не наблюдается зернистости и твердых механических включений.
Стабильность разработанной мази: стабильность мази проверяли путем центрифугирования на центрифуге медицинской лабораторной «Armed». Для проведения этого эксперимента брали по 5,0 г мази, помещали в пробирки Эппендорфа для центрифугирования и центрифугировали в течение 5 мин при 600 об/мин. После завершения центрифугирования мазь не расслаивалась, не теряла первоначальных свойств, была гомогенна, в целом стабильность не нарушалась.
Термостабильность проверяли путем выдерживания в сухожаровом шкафу при температуре +45 °С в течение 24 ч алюминиевых туб, наполненных исследуемой мазью. Также алюминиевые тубы с мазью выдерживали в морозильной камере при температуре 6–7 °С в течение 24 ч. После воздействия холода мазь сохраняла первоначальные свойства и общую стабильность.
Подлинность проверяли путем проведения качественных реакций на флавоноиды:
1) с алюминия хлоридом – ярко-желтое окрашивание с яркой флуоресценцией в УФ-свете;
2) с железа хлоридом (III) – темно-зеленое окрашивание;
3) цианидиновая реакция дает розово-оранжевый цвет.
Количественное содержание флавоноидной микронизированной фракции проводили спектрофотометрическим методом – содержание действующих веществ мази составило не менее 64,58 %.
Выводы
1. Разработана мягкая лекарственная форма на базе комплекса флавоноидов.
2. Проведенные биофармацевтические исследования (in vitro) показали, что мазевая основа, включающая в состав «ПЭГ400 – ПЭГ1500 (7:3)», обеспечивает максимальное высвобождение флавоноидной микронизированной фракции.
3. Установлен состав – концентрация 2 % и рациональная технология мази.
4. Проведенные исследования позволили определить показатели норм качества для разработанной мази:
- описание;
- стабильность;
- термостабильность;
- подлинность;
- количественное содержание флавоноидной микронизированной фракции – не менее 64,58 %.
Библиографическая ссылка
РАЗРАБОТКА И БИОФАРМАЦЕВТИЧЕСКАЯ ХАРАКТЕРИСТИКА МАЗИ ФЛЕБОПРОТЕКТОРНОГО ДЕЙСТВИЯ, СОДЕРЖАЩЕЙ ФЛАВОНОИДНЫЙ КОМПЛЕКС // Научное обозрение. Медицинские науки. 2021. № 2. С. 40-45;URL: https://science-medicine.ru/ru/article/view?id=1177 (дата обращения: 05.01.2026).
DOI: https://doi.org/10.17513/srms.1177
 science-review.ru
science-review.ru