ПВ – это патологическое накопление жидкости между листками плевры, которое происходит в результате нарушения баланса между её образованием и абсорбцией. При ХБП, согласно исследованиям O.J. Bintcliffe и соавт. (2016 г.), ПВ является весьма распространенным явлением, особенно у больных, находящихся на последней стадии данного заболевания, и у больных, получающих гемодиализ [1]. По мнению G.T. Kinasewitz (1997 г.), следует выделять два основных механизма образования ПВ при ХБП: 1. Развитие нефротического синдрома и, как следствие, снижение онкотического давления плазмы за счет протеинурии. 2. Гиперволемия, развивающаяся в результате нарушения экскреции жидкости и приводящая к повышению гидростатического давления в сосудах [2]. Согласно наблюдениям М.В. Шестаковой и соавт. (2011 г.), основной причиной возникновения ХБП во всем мире является сахарный диабет [3]. Согласно исследованиям E.M. DeBiasi (2015 г.) и S.P. Walker (2017 г.), у больных с ХБП при появлении ПВ статистически достоверно увеличивается смертность [4, 5].
ПВ при ХБП по своей природе является транссудатом, но в редких случаях терминальной стадии поражения почек может иметь место уремический плеврит, выпот при котором носит экссудативный характер [6]. Патогенез и лечение уремического плеврита до сих пор является вопросом до конца не решенным, последнее исследование H.M. Seo (2019 г.) показало успешное применение высоких доз преднизолона в лечении пациентки с двусторонним уремическим плевритом [7]. Медикаментозное лечение транссудативного ПВ при ХБП заключается в уменьшении потребления поваренной соли и жидкости, применение различных групп диуретиков, а также переливание раствора альбумина.
Хирургическая помощь пациентам с ПВ при ХБП имеет смысл только у пациентов, резистентных к медикаментозному лечению и проведению сеансов гемодиализа. Наличие одышки и рентгенологически подтвержденного ПВ является поводом для проведения периодического торакоцентеза, что, по мнению J. Nathan и соавт. (2011 г.), сопряжено с развитием таких осложнений, как пневмоторакс и эмпиема плевры [8]. Традиционно считается, что ведение пациентов с ПВ при ХБП сводится к лечению основного заболевания и периодической эвакуации выпота путем плевральной пункции, постановка дренажной трубки является нежелательной процедурой, которая приведет к неконтролируемой потере жидкости и вместе с ней белковых фракций и электролитов [9]. Возможно применение повторных терапевтических пункций плевральной полости при медленной реаккумуляции жидкости (меньше одного месяца). Одним из вариантов лечения является проведение процедуры химического плевродеза, который обширно применяется при злокачественном ПВ и спонтанном пневмотораксе [9, 10].
Химический плевродез (ХП) – процедура, направленная на создание асептического воспаления листков плевры с последующей их облитерацией, путем введения в плевральную полость различных химических агентов. Последние десятилетия данный вопрос активно изучается, и уже известно несколько эффективных веществ для успешного проведения данной процедуры. Условием возможности проведения ХП является полное расправление легкого, подтвержденное рентгенологически. Соответственно противопоказанием к данной процедуре является ригидное легкое или «панцирное легкое» и невозможность эвакуации плевральной жидкости при образовании осумкованных полостей.
Согласно работе А.П. Колесника и соавт. (2016 г.), наиболее распространенными агентами являются порошкообразный тальк, производные тетрациклина, блеомицин [11, 12]. Основными критериями для выбора вещества для ХП являются безопасность, доступность и эффективность. Несомненно, вышеописанные вещества удовлетворяют всем критериям, но для нашей страны проблемой является финансовая доступность данных препаратов. Практически все химические агенты вызывают неспецифическую воспалительную реакцию, развитие фибринозного плеврита, что ведёт к облитерации плевральной полости. Кроме того, тальк вызывает гистиоцитарную и гранулематозную реакцию как инородное тело. Таким образом, на эффективность процесса фибринообразования способно влиять одновременное с ХП применение гормональных препаратов и нестероидных противовоспалительных средств.
Наиболее доступными, но не менее эффективными с этой точки зрения являются такие вещества, как йодповидон и нитрат серебра [13, 14]. Малоизученным также является вопрос применения ХП при ПВ транссудативного характера. А.Л. Акопов и соавт. (2017 г.) поделились опытом применения блеомицина в качестве агента для ХП у пациентов с транссудативным ПВ при печеночной недостаточности, эффективность данной методики составила 86 % при минимальных побочных эффектах [15].
Цель исследования: провести оценку методики плевродеза, описанной С.А. Плаксиным (2014 г.). Оценить эффективность и безопасность применения йодповидона в лечении пациентов с транссудативным ПВ при ХБП.
Материалы и методы исследования
В отделении торакальной хирургии Национального госпиталя при Министерстве здравоохранения Кыргызской Республики в период с декабря 2019 по март 2021 г. находилось шесть пациентов с резистентным к медикаментозному лечению ПВ, осложнившим течение ХБП, четыре женщины и двое мужчин в возрасте от 47 до 82 лет. Все шесть пациентов длительно страдали сахарным диабетом, который в последующем осложнился ХБП, причем у двух пациентов сахарный диабет сочетался с застойной сердечной недостаточностью. Учитывая длительный анамнез основного заболевания, данные пациенты неоднократно получали консервативное лечение в эндокринологических и нефрологических отделениях. Несмотря на это, течение сахарного диабета осложнилось развитием ХБП. Двусторонний ПВ был диагностирован у четырёх пациентов (57,1 %), правосторонний характер накопления жидкости у двоих (28,6 %) и левосторонний у одного (14,3 %). Данным пациентам неоднократно производились пункции плевральной полости с эвакуацией жидкости от 600 мл до 3 л, на протяжении от трех месяцев до двух лет, интервал между торакоцентезами составил от двух недель до двух месяцев. Невзирая на проводимую медикаментозную терапию, направленную на восстановление онкотического давления плазмы крови и улучшение экскреторной функции почек, гидроторакс носил рецидивирующий характер.
Нами применялась методика плевродеза 10 % раствором бетадина (йодповидон) производства ЗАО «Фармацевтический завод Эгис» по лицензии фирмы «Мундифарма» (Швейцария) в сочетании с 40 % раствором глюкозы. Всем пациентам было произведено дренирование плевральной полости на стороне ПВ, при двустороннем гидротораксе постановка плеврального дренажа осуществлялась на стороне большего скопления жидкости. Основным требованием к проведению индукции плевродеза служило полное расправление легкого, что было подтверждено рентгенологическим исследованием.
Перед ХП, с целью обезболивания, интраплеврально было введено 50 мл 1 % раствора лидокаина. Из нашего опыта, введение 100 мл 1 % раствора лидокаина, предложенное в исследовании С.А. Плаксина, вызывало такие симптомы, как головокружение, нарушение координации движения, заторможенность сознания, повышенную жизнерадостность, снижение артериального давления и учащение пульса. По нашему мнению, объем в 50 мл не вызывает у пациентов симптомов, связанных с реабсорбцией лидокаина. После введения анестетика дренаж перекрывался, а пациенту было рекомендовано совершать активные дыхательные движения и менять положение тела, экспозиция составляла 20 мин, с последующим удалением анестезирующего средства. В это время подготавливался раствор для плевродеза, в одном шприце смешивалось 20 мл 10 % раствора йодповидона и 40 % раствора глюкозы в объеме 80 мл, после введения, дренаж перекрывался на 2 ч, при этом больному также было рекомендовано менять положение тела каждые 30 мин и увеличить дыхательную экскурсию грудной клетки.
Производился контроль отделяемой жидкости каждый день, при уменьшении ежесуточного объема до 100 мл дренаж из плевральной полости удалялся.
Контрольная рентгенография производилась через 1, 3 и 6 мес. Помимо индукции плевродеза все пациенты получали медикаментозную терапию под контролем эндокринолога и нефролога. Эффективность плевродеза оценивалась как рентгенологически, так и клинически.
Результаты исследования и их обсуждение
У трех пациентов (43 %) перед дренированием плевральной полости имел место субтотальный гидроторакс, рентгенологически затенение достигало переднего отрезка II и III ребра (рис. 1), у трех пациентов (43 %) уровень жидкости достигал IV и V ребра и у одного пациента (14 %) уровень ПВ был ниже V ребра. У всех пациентов имели место одышка разной степени, сухой кашель и тяжесть в грудной клетке, все симптомы были нивелированы после осушения плевральной полости.
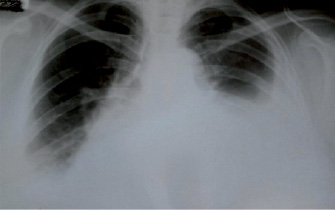
Рис. 1. Рентгенограмма органов грудной клетки пациента А. Двусторонний гидроторакс. В прямой проекции слева отмечается субтотальное гомогенное затенение за счет большого количества жидкости, справа отмечается затенение в нижних отделах за счет малого объема жидкости
Ежесуточное отделение жидкости до проведения процедуры ХП составило от 300 до 950 мл. В момент введения химического агента болевой синдром не наблюдался у четырех пациентов (71,4 %), двое пациентов (28,6 %) отмечали болевые ощущения в одной половине грудной клетки, оценка проводилась по визуально-аналоговой шкале (ВАШ) и составила 6 и 8 баллов соответственно. Болевые ощущения были купированы однократным введением нестероидных противовоспалительных средств. В последующие 72 часа у одной пациентки отмечалось однократное повышение температуры тела до 39 °С без каких-либо дальнейших последствий.
Средняя продолжительность нахождения дренажной трубки в плевральной полости составила 3,43 дня. Объем жидкости в динамике уменьшился до 100 мл, после чего плевральная трубка была удалена. На контрольных рентгенограммах на стороне проведения ХП легкое полностью расправлено, жидкости в плевральной полости нет (рис. 2).
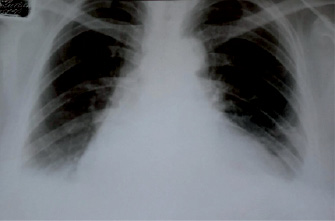
Рис. 2. Динамика рентгенологического снимка пациента А. В прямой проекции отмечается положительная динамика в виде полного расправления левого легкого, жидкости нет
На данный момент не все шесть пациентов прошли три контрольных осмотра, но эффект в виде отсутствия скопления ПВ на стороне ХП был достигнут у всех шести пациентов, что составило 100 %. Каких-либо поздних осложнений после проведения ХП у больных не наблюдалось.
Ведение пациентов с ХБП в терминальных стадиях, осложнившейся появлением ПВ, является вопросом сложным и до конца не решенным. Известно, что появление жидкости в плевральной полости у больных с ХБП значительно увеличивает смертность [4, 5].
Пункция плевральной полости с последующей эвакуацией ПВ является паллиативным видом помощи, эффективно устраняющим одышку, но не решающим проблему основного заболевания. Также с каждой порцией удаляемой жидкости из организма выводятся белковые фракции, что ведет к развитию порочного круга [16]. Дренирование плевральной полости также не является выходом из этой ситуации, так как ведет к постоянной потере жидкости и несет дополнительные осложнения в виде возможного развития эмпиемы плевры [2].
Химический плевродез – весьма эффективный способ борьбы с рецидивирующими злокачественными ПВ и в качестве завершающего этапа операции при буллезной болезни легких [9, 10]. Несмотря на широкую освещенность данного вопроса, в нашей стране нет опыта применения данного вида лечения в отношении транссудативных ПВ. Традиционным лечением больных с транссудативными ПВ является лечение их основного заболевания, но это не всегда дает значимый эффект, а состояние больных с каждым торакоцентезом способно ухудшаться.
В данной статье представлены результаты лечения шести пациентов с транссудативным ПВ, который развился на фоне ХБП. В качестве плевросклерозанта был выбран йодповидон, который при попадании в плевральную полость вызывает ожог ее листков и дальнейшую их адгезию между собой. Основным преимуществом йодповидона является его доступность и безопасность. Что касается его эффективности, то согласно исследованиям, он уступает таким агентам, как тальк, производные тетрациклина и нитрат серебра.
В литературе имеется ограниченное количество информации о применении йодповидона и глюкозы в качестве средств для ХП, а их применение при транссудативном ПВ является вопросом не затронутым. В нашем исследовании прекращение скопления ПВ было достигнуто во всех шести случаях (100 %). Большинство пациентов при этом не испытывали болевых ощущений, а температурная реакция наблюдалась только в одном случае. Такие распространенные плевросклерозанты, как тальк, тетрациклин, нитрат серебра, йодповидон, являются местно-раздражающими средствами и их фибриногенный эффект появляется опосредованно через воспалительный процесс. Несмотря на многолетний опыт применения ХП при рецидивных ПВ и спонтанном пневмотораксе, поиск химического вещества продолжается по сей день. Идеальным средством будет вещество, обладающее хорошим проадгезивным свойством и с отсутствием провоспалительного эффекта.
Заключение
1. Введение 50 мл 1 % раствора лидокаина перед индукцией плевродеза является эффективным способом обезболивания и не оказывает эффектов, связанных с его всасыванием.
2. Раствор йодповидона и глюкозы может успешно применяться у пациентов с транссудативным плевральным выпотом при ХБП. Данная методика отвечает всем критериям, предъявляемым к плевросклерозантам: эффективность, доступность и безопасность.
Библиографическая ссылка
Егай А.А., Бебезов Б.Х., Казакбаев А.Т., Тентимишев А.Э., Двумаров А.А. ХИМИЧЕСКИЙ ПЛЕВРОДЕЗ ЙОДПОВИДОНОМ В ЛЕЧЕНИИ ПЛЕВРАЛЬНОГО ВЫПОТА ПРИ ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК // Научное обозрение. Медицинские науки. 2021. № 3. С. 74-78;URL: https://science-medicine.ru/ru/article/view?id=1194 (дата обращения: 03.12.2025).
DOI: https://doi.org/10.17513/srms.1194
 science-review.ru
science-review.ru