Гормон щитовидной железы (Т3) – трийодтиронин играет решающую роль в обмене веществ и физиологии органов, а заболевания щитовидной железы являются одним из наиболее распространенных типов нарушений обмена веществ. Синдром гипотиреоза является едва ли не самой часто встречающейся патологией эндокринной системы. Дисфункция щитовидной железы является одним из ведущих эндокринных заболеваний. Предыдущие данные показывают, что около половины населения с дисфункцией щитовидной железы остается невыявленной. Характер дисфункции щитовидной железы, по-видимому, зависит от йодного статуса населения. Распространенность дисфункции щитовидной железы может быть параметром, который следует учитывать при оценке йоддефицитных заболеваний в популяции. По европейским оценкам, его распространённость достигает 5 % населения [1–3], при этом еще до 5 % людей может иметь недиагностированную недостаточность гормонов щитовидной железы. Недостаток или избыток Т3 у людей приводит к аномальной скорости метаболизма и неблагоприятно влияет на физиологические функции многих органов, таких как сердце и печень. Лигандный рецептор тиреоидного гормона (ТГ) негативно регулирует синтез и секрецию ТТГ у гипофизарных тиреотрофов, что приводит к резкому снижению концентрации ТТГ в сыворотке. Щитовидная железа вырабатывает два гормона на основе тирозина – Т4 (тироксин) и Т3 (трийодтиронин). Преобладающей формой циркулирующего ТГ является Т4, который превращается в биоактивный Т3 внутри клеток с помощью двух разных йодтиронинов, «активирующих» дейодиназы: дейодиназы 1 типа (D1) или дейодиназы 2 типа (D2). Дейодиназы (или дегалогеназы) – это группа ферментов, способных деиодинировать метаболиты деградации гормонов щитовидной железы, такие как дийодтирозин (ДИТ) и монойодтирозин (МИТ). Дейодиназа 3 типа (D3) инактивирует Т4, превращая Т3 и Т4 в 3,3-дийодтиронин (Т2), тем самым блокируя биологические эффекты ТГ на клеточно-специфической основе. До 3 % населения в западных странах получают заместительную терапию гормонами щитовидной железы, большинство – только Т4. Однако адекватность этого для замены физиологических потребностей и устранения симптомов у пациентов остается спорной из-за нескольких наблюдений. Эскобар-Морреале и др. сообщали, что у крыс, подвергнутых тиреоидэктомии, невозможно нормализовать тканевые уровни гормонов щитовидной железы (Т4 и Т3) путем замены только на Т4 или только на Т3. У людей пациенты, получающие монотерапию Т4, имеют значительно более высокое соотношение Т4 к Т3 в сыворотке крови для аналогичного уровня ТТГ, чем люди с нормальной функцией щитовидной железы [4]. Дейодиназа 1 типа – образование активного гормона Т3 в периферических тканях. Дейодиназа 2 типа – защита важных органов от колебаний тиреоидных гормонов. Дейодиназа типа 3 – перевод активных гормонов T3 и Т4 в неактивные rT3 и Т2. Существуют большие различия в экспрессии дейодиназы в разных тканях, что приводит к значительным различиям в относительном вкладе сывороточных концентраций Т4 и Т3 в действие гормонов щитовидной железы. В исследованиях на грызунах было подсчитано, что сывороточный Т3 способствует 87 % внутриклеточного Т3 находится в почках, но только 50 % в гипофизе и всего 20 % в коре головного мозга, остальное поступает в результате локального дейодинирования сывороточного Т4 D2.
Цель исследования – изучить синдром гипотериза и исследовать роль трийодтиронина в диагностике.
Материалы и методы исследования
Зарубежные и российские научные источники по теме «Синдром гипотериоза: роль трийодтиронина в диагностике».
Большая часть циркулирующего Т3 образуется в результате превращения Т4 в Т3 под действием D1, который локализуется в плазматической мембране и экспрессируется главным образом в щитовидной железе и почках. Тем не менее, уровни ТГ в сыворотке могут неточно отражать их уровни в тканях, поскольку активирующая дейодиназа (D2) может локально изменять передачу сигналов ТГ тканеспецифическим образом. Левотироксин представляет собой синтетическую версию секретируемого гормона щитовидной железы тироксина (Т4), который полностью имитирует все физиологические эффекты Т4. LT4 – левотироксин используется в качестве заместительной терапии при первично-тиреоидном, вторично-гипофизарном и третично-гипоталамическом гипотиреозе. Несмотря на то, что T4 в природе присутствует в виде рацемической смеси лево- и правосторонней форм, LT4 вырабатывается в виде левоизомера из-за его большей физиологической активности, чем правосторонняя форма [5].
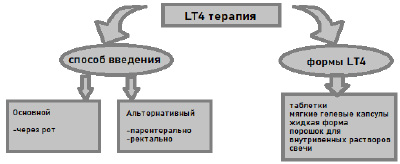
Терапия левотироксином
В последнее десятилетие левотироксин (LT4) используется для лечения часто встречающихся эндокринопатий, таких как заболевания щитовидной железы. Он регулярно используется в случаях клинического и субклинического гипотиреоза. Супрессивная терапия LT4 также является частью схемы лечения злокачественных новообразований щитовидной железы после тиреоидэктомии. В исследовании показано, что замена левотироксина (LT4) экзогенной формой Т4, что значительная часть пациентов, принимающих левотироксин (LT4), испытывает гипотиреоидные симптомы (потеря памяти, увеличение веса, усталость, депрессия и снижение качества жизни), несмотря на нормальные значения гормона, стимулирующего щитовидную железу (ТТГ) [5]. Во время замены LT4 экзогенной формой Т4 , уровни активного гормона трийодтиронина (T3) строго зависят от активации типа 2-дейодиназы (D2) LT4. Одна из причин сохранения симптомов гипотиреоза у части пациентов на монотерапии левотироксином может быть связана с генетическими факторами. Выдвинуто предположение, что в данном случае имеет значение однонуклеотидный полиморфизм (ОНП) гена, кодирующего D2, а именно Thr92Ala. Полиморфизм Thr92Ala и 258 G/A в гене DIO2 были связаны с различными клиническими состояниям [6]. Сообщается, что полиморфизм Dio2 Thr92Ala связан со многими расстройствами, такими как остеоартрит, гипертония, болезнь Грейвса, болезнь Кашина – Бека, биполярное расстройство, депрессия и когнитивные нарушения. Кроме того, существуют последствия для медицинских ресурсов от наличия аномальной биохимии щитовидной железы, так как пациенты с большей вероятностью нуждаются в повторных анализах крови, часто корректируют дозу левотироксина, испытывают повторяющиеся симптомы, влияющие на благополучие и качество жизни. Снижение качества жизни очень распространено среди пациентов с гипотиреоидной железой, особенно в отношении энергии, мотивации, физических способностей, внешнего вида и веса. Пациенты с гипотиреоидной железой даже с нормальным, по-видимому, уровнем ТТГ сообщают о снижении психологического благополучия и низком качестве жизни. Некоторые пациенты с гипотиреозом продолжают сообщать о недостаточном контроле симптомов, а также о генерализованном недомогании, несмотря на соответствующую дозировку LT4, при этом уровни тиреотропного гормона (ТТГ) находятся в пределах нормы. В настоящее время появляется все больше доказательств, описывающих влияние различных факторов на гормональную терапию щитовидной железы. Некоторые из этих факторов включают в себя массу тела, беременность, сопутствующие заболевания, консистенцию и качество левотироксина, лекарственные взаимодействия и сроки дозы, а также поведенческие факторы, такие как показатели приверженности. Фармакокинетические факторы также играют свою роль, поскольку левотироксин поглощается из желудка, а тонкий кишечник и его оптимальное поглощение зависят от кислой среды желудка. Известно, что через этот механизм нарушают поглощение нескольких факторов, включая использование солей кальция или железа, ингибиторов протонного насоса, атрофического гастрита (парочная анемия) и целиакия. Фармакогеномные ассоциации также могут иметь отношение к адекватности терапии тироксином, и количество доказательств в этой области растет. Например, в метаболическом пути тироксина было показано, что полиморфизмы в дейодиназе типа 2, DIO2, (Thr92Ala) влияют на дозу левотироксина, необходимую для достижения целевых уровней ТТГ. Замена LT4 у тиреоидэктомизированных животных не восстановила эвтиреоз во всех тканях организма, в то время как комбинированная терапия T4+T3 это сделала. У пациентов с гипотиреозной железой лечение T4+T3 не имело преимущества перед стандартной терапией LT4. В некоторых клинических руководствах отмечается необходимость применения комбинации левотироксина и лиотиронина (L-T3) – синтетической формы гормона Т3 [7–9]. Действительно, международные рекомендации советуют только LT4 для лечения гипотиреоза. В 2012 г. Европейская ассоциация щитовидной железы (ETA) была единственной организацией, которая тщательно рассмотрела этот вопрос, поскольку комбинированная терапия была в центре внимания специального 15-страничного отчета целевой группы, созданной по заказу ETA для изучения этого клинического вопроса. ETA в конечном счете определила, что лечение T3 следует рассматривать только как экспериментальное лечение. ETA не рекомендовала рутинную терапию T3 и заявила, что ее рекомендации по применению T3 были направлены только на повышение его безопасности и противодействие его неизбирательному применению [7]. Тем не менее комбинированная терапия LT4 + LT-3 может быть рассмотрена для пациентов с гипотиреозом, которые имеют постоянные жалобы, несмотря на значения ТТГ в сыворотке крови в пределах эталонного диапазона при условии, что они ранее получили поддержку в борьбе с хронической природой своего заболевания, а связанные с ними аутоиммунные заболевания были исключены. Гипотиреоз чаще всего вызывается хроническим аутоиммунным тиреоидитом (болезнь Хасимото) и абляцией щитовидной железы при болезни Грейвса. В крупном британском исследовании частота других аутоиммунных расстройств составила 9,67 % у 2791 пациента с болезнью Грейвса и 14,3 % у 495 пациентов с болезнью Хасимото. Ревматоидный артрит был наиболее распространенным сосуществующим аутоиммунным расстройством (находится в 3,15 % болезни Грейвса и 4,24 % болезни Хасимото). Относительные риски почти всех других аутоиммунных заболеваний были значительно увеличены (RR >10 при пагубной анемии, системной красной волчанке, болезни Аддисона, целиакии и витилиго). Многие из этих состояний могут остаться незамеченными в течение длительного времени из-за неспецифического характера сопутствующих симптомов [10]. У пациентов, перенесших тиреоидэктомию, наблюдается нарушение выработки гормонов щитовидной железы, что требует заместительной гормональной терапии во избежание развития гипотиреоза. На сегодняшний день стандартом лечения в таких случаях является долгосрочная схема лечения LT4. В исследовании S. Kanji и соавт. ретроспективно оценивались показатели 70 пациентов с синдромом эутиреоидной патологии, находящихся в отделении интенсивной терапии в критическом состоянии и получавших трийодтиронин. У всех исходные концентрации свободного T3 в сыворотке крови были ниже нижнего предела референтного диапазона нашей лаборатории, а у 22 (31 %) пациентов также были низкие концентрации тироксина (T4). Наиболее часто назначаемые заместительные дозы составляли 25 и 50 мкг в среднем на семь дней, и почти половина пациентов также получали сопутствующую добавку Т4. Сывороточные гормоны щитовидной железы были доступны у 48 из 70 пациентов (69 %). Нормализация концентрации свободного Т3 в сыворотке крови произошла у 30 из 48 пациентов (63 %) при медиане 8 дней. Была идентифицирована зависимость доза-реакция. Новые нежелательные явления во время терапии встречались реже, чем в начале исследования. На фоне проводимого лечения, у пациентов отмечалась нормализация уровня Т3 в сыворотке крови при отсутствии нежелательных реакций со стороны сердечно-сосудистой системы [11]. Данные работы А. Pingitore и соавт. демонстрируют не только безопасность применения L-Т3 у пациентов с острым инфарктом миокарда, но и улучшение функции сердца по данным эхокардиографического исследования и МРТ при сравнении с показателями пациентов, получавших стандартное лечение. Доза LT4 для каждого пациента должна быть оптимизирована, чтобы избежать потенциальных побочных эффектов, таких как потеря веса, потливость, тревога, бессонница, остеопороз и учащение пульса. Таким образом, лечение LT4 не рекомендуется пациентам с недавно перенесенным сердечным приступом [12]. Гормоны щитовидной железы в избытке влияют на сердечно-сосудистую систему за счет увеличения частоты сердечных сокращений, сократительной способности миокарда, массы левого желудочка и предрасположенности к наджелудочковым аритмиям. Липофильный Т3 связывается с рецептором гормона щитовидной железы (ТР) при проникновении в ядро кардиомиоцита. Активация TR приводит к стимуляции транскрипции генов тяжелой альфа-цепи миозина, кальциевой АТФазы, Na/K-АТФазы, бета-1-адренорецептора и предсердного натрийуретического пептида. Субклинические тиреопатии могут нанести вред сердечно-сосудистой системе и проявляться увеличением сердечно-сосудистой заболеваемости и смертности на 20–80 %. Клинический гипертиреоз связан с увеличением риска серьезных сердечно-сосудистых заболеваний, обычно проявляющихся ухудшением сердечной недостаточности, включая сердечную недостаточность с высоким выбросом. Тем не менее пациенты без известных сердечно-сосудистых заболеваний могут испытывать сердечно-сосудистые осложнения после лечения LT4, что неудивительно, учитывая роль ТГ в регуляции сердечной деятельности. Это связано с повышенным риском развития сердечных аритмий, в первую очередь ФП, а также остеопороза. Хотя исследования показывают, что у пациентов, получавших LT4, с уровнем ТТГ от 0,04 до 0,4 мМЕ/мл не наблюдалось повышенного риска сердечно-сосудистых заболеваний, аритмий или остеопоротических переломов. В прошлом была выдвинута гипотеза о роли гормонов щитовидной железы в эволюции человека. T3, метаболически активная форма, происходит от экстратиреоидальной конверсии T4 ферментом дейонидазы 2 (D2), кодируемым геном DIO2. У пациентов с дефицитом щитовидной железы снижение уровня свободного T3 было связано с полиморфизмом rs225014 A/G в DIO2, что вызывает замену треонинааланином (p.Thr92Ala) на уровне белка [13].
Результаты исследования и их обсуждение
Генотипирование DIO2 выявило связь между низкими значениями FT3 и Thr92Ala. В частности, средний уровень FT3 в постхирургии был значительно ниже у пациентов с мутировавшими аллелем (аллели), чем у пациентов дикого типа, у которых постхирургические уровни FT3 были аналогичны уровням до операции. Изменение −258 G/A не было связано с гормональным изменением. Мы обнаружили, что эндогенные дикие типы D2 и Thr92Ala имеют одну и ту же субклеточную локализацию, но отличаются стабильностью белка. Важно отметить, что Thr92Ala снизил D2-опосредованный тироксин до преобразования T3. Тиреоидэктомированные пациенты, несущие Thr92Ala, подвергаются повышенному риску снижения концентрации внутриклеточных и сывороточных T3, которые недостаточно компенсируются LT4, тем самым предоставляя доказательства в пользу индивидуального лечения гипотиреоза [14]. Некоторые исследования предположили, что это рецессивная модель наследования из-за «генотипов Thr/Thr и Thr/Ala, показывающих сходство в биохимических характеристиках». Тем не менее мы считаем, что все еще необходимы дальнейшие исследования и необходимы анализы, выполненные в доминирующей модели наследования. Нет существенных различий в Ala/Ala + Ala/Thr и Thr/Thr.
Заключение
Во многих исследованиях выявлено, что терапия LT4 обладает двойным эффектом: восполнение вновь возникшего дефицита гормонов щитовидной железы и подавление локального и отдаленного распространения злокачественных новообразований при раке. Также многие исследования показали, что полиморфизм Thr92Ala связан с сахарным диабетом 2 типа (T2DM), резистентностью к инсулину и индексом массы тела (ИМТ). Было показано, что носители аллеля Ala имеют чистое снижение удаления глюкозы. Полиморфизмы Dio2 Thr92A и пероксисомы-активируемые пролифератором рецептор-гамма2 (PPARγ2) Pro2Ala взаимодействуют в модуляции систолического и диастолического артериального давления и метаболического синдрома. Кроме того, сочетание этого полиморфизма и β3-адренергических рецепторов Trp63Arg приводит к увеличению ИМТ, что указывает на синергетический эффект этих двух полиморфизмов. Некоторые исследования показали, что полиморфизм Thr92Ala связан с сахарным диабетом 2 типа (T2DM), резистентностью к инсулину. Тем не менее исследование сердца Фремингема показало, что нет никакой связи полиморфизма Thr92Ala с рисками T2DM или гипертонии. Хотя скорость Dio2 была снижена в щитовидной железе и скелетной мышце у людей, гомозиготных для аллеля Ала, замена ThrtoAla в кодоне 92 не находится рядом с активным сайтом фермента.
Библиографическая ссылка
Мартьянова Е.В., Капитончева К.Н. СИНДРОМ ГИПОТИРЕОЗА: РОЛЬ ТРИЙОДТИРОНИНА В ДИАГНОСТИКЕ // Научное обозрение. Медицинские науки. 2022. № 3. С. 47-51;URL: https://science-medicine.ru/ru/article/view?id=1254 (дата обращения: 03.03.2026).
 science-review.ru
science-review.ru