Грыжевое выпячивание передней брюшной стенки во все времена привлекает особое внимание врачей-хирургов во всех странах мира [1–3]. Повышенный интерес хирургов к данной патологии обусловлен серьезными последствиями, связанными с жизненно угрожающим осложнением – ущемлением, некрозом тканей. В первые часы заболевания риск жизнеугрожающих состояний остается высоким, и связано это с развитием патологических процессов, возникающих в ущемленном участке органа, что часто приводит к высоким уровням летальности [4–6].
Герниология (наука о грыжах и методах лечения грыж) в Кыргызской Республике, так же как и во всех развитых странах мира, является одним из динамично развивающихся разделов практической хирургии. Все более современные технологии, сетчатые эндопротезы, применяются в клинической практике, при этом подкрепляются доказательные аспекты [7–9]. Однако, опираясь на научную периодическую литературу, с уверенностью можно сказать, что оценка реактивности иммунной системы, а именно системы субпопуляции лимфоцитов на проводимые методы герниопластики, окончательно на сегодняшний день не выработана. Анализируя научную литературу, информацию на съездах, конференциях, ведущие специалисты сходятся в том, что высокая частота встречаемости этой нозологии, методы пластики грыжевых ворот основываются на данных иностранных научных изданий [1, 2]. С другой стороны, сложность вопроса обусловлена небольшим количеством трудов, посвященных данной тематике, в особенности патогенеза грыж передней брюшной стенки [10–12]. Эти исследования, а точнее их данные в достаточной степени не могут быть экстраполированы для жителей нашей республики, что наталкивает на определенные трудности в проводимых лечебных, профилактических мероприятиях и при рецидиве послеоперационных грыж [13–15]. Из-за неудовлетворительных результатов хирургического лечения идет активное изучение иммунологического статуса больного до операции и после, что является актуальным и значимым для улучшения показателей качества жизни в раннем послеоперационном периоде.
Цель нашего исследования – определение активности иммунной реакции у пациентов вентральными грыжами после перенесенных операций на органах брюшной полости, которым выполнены ауто- или аллопластические методы герниопластики.
Материалы и методы исследования
Иммунологические исследования были проведены у 40 пациентов с вентральными грыжами после перенесенных операций на органах брюшной полости. По полу распределены следующим образом: 62,25 % составили мужчины 37,5 % – женщины, 25 и 15 пациентов соответственно. У лиц мужского пола средний возраст составил 45,6 ± 2,3 лет, а у женского пола – 57,2 ± 3,2 лет [15, 16]. Все пациенты были разделены на две группы поровну. I группу, 20 больных, составили пациенты, которым применены аутопластические методы грыжесечения и пластики грыжевого дефекта [15, 16]. II группу также составили 20 больных, которым были выполнены аллопластические способы герниопластики, с использованием монофиламентного полипропиленового сетчатого эндопротеза, не рассасывающегося, не окрашенного, со стандартным плетением, производства Coviden Parietene Macroporous Mesh (Стамбул, Турция).
Пациенты были прооперированы за период с 01.12.2020 по 30.04.2021 в Национальном хирургическом центре имени акад. М.М. Мамакеева Министерства здравоохранения Кыргызской Республики [15].
Исследования иммунологических показателей проведены на базе НЦФ МЗ КР в иммунологической лаборатории (зав. лаборатории – к.м.н. Е.В. Дуденко, исполнитель – С. Сыдыкова) [15]. Комплекс иммунологического обследования включал определение цитокинов CD-3, CD-4, CD-8, CD-20, IL-6, IL-10 и иммуноглобулины A, M, G [15].
Всем пациентам проводилась предоперационная подготовка с целью исключения послеоперационных осложнений. Пациенты, у которых имелись сопутствующие заболевания, были консультированы узкими специалистами, им было назначено соответствующее лечение. Больным за 60 мин до оперативного вмешательства выполнялась антибиотикопрофилактика препаратом Цефазолин 1,0 внутримышечно и Метронидазол 100,0 мл внутривенно [15].
Статистическая обработка проведена с применением пакета прикладных программ «Statistica for Windows 6.0». При этом определяли среднее значение, среднеквадратическое отклонение и среднюю ошибку с проверкой показателей на выполнение нормального закона распределения по критерию Стьюдента [15]. Статистически достоверными различия считались при уровне р ≤ 0,05 [15].
Результаты исследования и их обсуждение
Учитывая, что после герниопластики сетчатым имплантатом из полипропиленовых материалов течение раневого процесса у больных с вентральными грыжами более благоприятное, а также существует вероятность применения этих протезов при самых различных размерах грыжевых ворот, метод аллопластики стал ведущим. Однако примерно у 40 % пациентов из этой исследуемой группы в динамике раневая экссудация превышала более 10 суток.
При выборе наиболее оптимального варианта предоперационной подготовки и ведения больных в послеоперационном периоде с вентральными грыжами после ранее перенесенных операций на органах брюшной полости следует брать в расчет не только размеры грыжевого кольца, но и размеры грыжевого дефекта, что не всегда учитывается.
Анализ течения раневого процесса показал следующие результаты. Раневой процесс в динамике без экссудации выявлен у 20 % пациентов, у 57,5 % больных экссудация отмечалась до 10 суток, а у 22,5 % пациентов раневая экссудация определялась больше 10 суток. Отмечено сокращение длительности истечения раневого экссудата в 2 раза. Это связано с новым методом дренирования раны: а именно создания вакуум-дренажа и метода подшивания подкожно-жировой клетчатки, также активно применяли бандаж.
При анализе зависимости клинических факторов от частоты раневого осложнения у пациентов с послеоперационными вентральными грыжами отмечены достоверные прогностические критерии. К ним относятся ожирение пациентов, размер грыжи у пациентов с послеоперационными грыжами живота.
Итак, у 23 % больных с ожирением I степени развились раневые процессы. У больных с грыжами разного размера после имплантации сеток среднего и большого размера с ожирением II–IV степени отмечены раневые осложнения в 39,5 % случаев. Ожирение II–IV степени достоверно коррелировало и с частотой раневого осложнения (р = 0,005).
При аллопластике с применением сеток малых размеров послеоперационные осложнения не были отмечены, при имплантации среднего размера сеток осложнения отмечены у 17,5 % больных, а при имплантации большого размера сеток осложнения со стороны раны выявлены в 45,5 % наблюдений. Отмечена статистическая достоверность влияния размера сеток при имплантации размерами больше 20х20 см от частоты раневого осложнения.
Отметим, что по раневому осложнению в группу риска входят пациенты с ожирением II–IV степени с послеоперационными вентральными грыжами, у которых грыжевые ворота в диаметре больше 10 см, а опухолевидное выпячивание больше 20 см, при этом имплантируемая сетка больше 20х20 см.
При исследовании первичного иммунного статуса было выявлено, что иммунокомпетентные клетки I типа не отличаются в исследуемых наблюдениях. Процентное соотношение лейкоцитов и моноцитов пациентов, которым проведена аутогерниопластика, составило 5,3±1,1 и 5,4±2,6 соответственно, а лимфоциты составили 28,4±6,2. До аутогерниопластики иммунокомпетентные клетки II типа определялись СD3 – 47,3±13,0, CD4 – 26,8±6,2, CD 8 – 30,3±5,6, CD 20 – 12,6±3,7.
Как видно на рис. 1, в раннем послеоперационном периоде у больных, которым выполнена аутопластика, уровень лейкоцитов снижен 5,3±1,02, в сравнении с показателем до операции 5,5±1,1, а у больных, которым произведена аллопластика, показатель лейкоцитов практически не изменен. Также в динамике уровень моноцитов до операции и после операции не изменен у больных, перенесших аутопластику, в отличие от больных, перенёсших аллопластику, показатели моноцитов после операции были повышены и составили 7,1±2,4.
Уровень лимфоцитов повышен у больных, перенесших аутопластику, после операции, что составило 30,4±5,9 и что достоверно отличается от исходных показателей (р > 0,05).
У больных, которым выполнена аутопластика, уровень лейкоцитов снижен, 5,3±1,02, в сравнении показателем до операции 5,5±1,1, а у больных, которым произведена аллопластика, показатель лейкоцитов практически не изменен. Также в динамике уровень моноцитов до операции и после операции не изменен у больных, перенесших аутопластику, в отличие от больных, перенёсших аллопластику, у них показатели моноцитов после операции были повышены и составили 7,1±2,4.
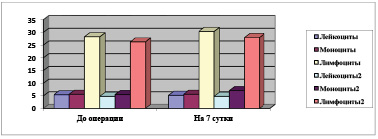
Рис. 1. Динамика показателей иммунокомпетентных клеток в обеих клинических группах в сравнении
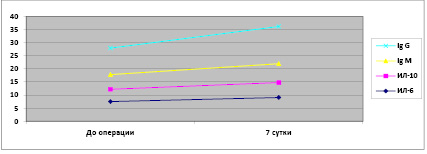
Рис. 2. Показатели цитокинов и иммуноглобулинов после аутопластики передней брюшной стенки
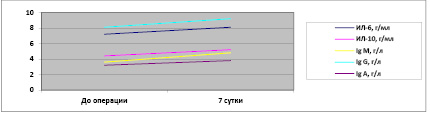
Рис. 3. Показатели цитокинов и иммуноглобулинов после аллопластики передней брюшной стенки
Уровень лимфоцитов повышен у больных, перенесших аутопластику, после операции, что составило 30,4±5,9 и что достоверно отличается от исходных показателей (р > 0,05).
В сравнительном аспекте, как отражено на рис. 2, показатели субпопуляций Т лимфоцитов в группе, которым выполнена аутопластика (CD3 – 49,06±12,7, CD4 – 28,4±5,8, CD8 – 31,9±5,7, CD20 – 14,06±3,5) и показатели субпопуляций Т лимфоцитов в группе, в которой выполнена аллопластика (СD3 – 48,7±10,9, CD4 – 28,4±5,8, CD8 – 32,08±5,8, CD20 – 13,1±2,7). Данные показатели повышены в обеих группах после оперативного вмешательства, что достоверно отличается от исходного уровня (р > 0,05).
При исследовании показателей цитокинов и иммуноглобулинов при ауто- и аллопластике выявлены следующие изменения, которые отображены в таблице (рис. 2 и 3).
На рис. 3 отображено, что до операции показатели цитокинов и иммуноглобулинов были в пределах нормальных значений после различных способов, но на седьмые сутки после операции уровни показателей повысились. А именно у пациентов, перенесших аутопластические способы герниопластики, достоверно отличаются от исходного уровня (р > 0,05).
У больных, перенесших аутопластические виды операций по поводу вентральных грыж, до операции уровень ИЛ-6 был 7,6±3,7. На седьмые сутки после операции ИЛ-6 составил 9,06±3,5, что достоверно отличается (р > 0,05).
Показатель IgM у больных, перенесших аутопластические способы, был выше после операции 7,3±2,7, чем исходное состояние 5,7±2,6 (р > 0,05).
Уровень IgG у пациентов, перенесших ауто- и аллопластические способы, до операции составил 10,2±5,6 и 8,2±4,3. А на седьмые сутки после операции – 14,3±3,6 и 9,3±2,6.
Пациенты, перенесшие аутопластические способы, по всем показателям выше на 2 % от исходного уровня (р > 0,05).
IgА во всех исследуемых группах до проведения операции был определен в пределах допустимых нормальных значений и равен был 2,6±1,4 и 3,3±1,8. После оперативного вмешательства на седьмые сутки показатель незначительно повысился и достиг порогового уровня 2,9±3,4 и 3,9±2,1.
При иммунологическом исследовании показателей крови у пациентов ПОВГ выявлены следующие изменения. По всем показателям идет тенденция к повышению. В I группе уровень лейкоцита повышен на +0,3±0,02, а во II группе показатели были в пределах нормы. Уровень моноцитов у больных, перенесших аллопластику, увеличился на +1,5±0,2.
При сравнении уровня лимфоцитов в обеих группах особых отличий не выявлено, и увеличение показателя составило всего лишь на +2±0,4 и +2±0,82 (р ˂ 0,05).
Как вы видите, имеется увеличение концентрации Т и В лимфоцитов с рецепторами GD3, CD 4, CD8, CD20 на седьмые сутки после операции у пациентов первой группы составило +1,85±0,3; +1,6±0,4; +1,6±0,2; +1,5±0,3. А у больных второй группы первоначальный уровень показателей был ниже и увеличился на +1,2±0,1; +1,4±0,2; +1,67±0,65; +1,03±0,45. Все данные показателей достоверно отличаются друг от друга (р > 0,05).
Уровень ИЛ6 и ИЛ 10 в послеоперационном периоде увеличился у пациентов первой группы на +1,55±0,2 и +1±0,9, во второй группе составил ИЛ 6+0,9±1,2, ИЛ 10 +0,8±1,2. Достоверно отличаются (р > 0,05).
При исследовании видно, что показатели клетки гуморального типа имели тенденции к повышению, что показывает результат.
Концентрация IgG в группе перенесших аутопластику по сравнению с показателями группы аллопластики была выше (+4,1±2,0 г/л против – +1,1±1,7), а в группе после (+0,4±2,0, +1,6± 0,1), что достоверно отличается (р > 0,05).
Заключение
Таким образом, выявлено, что у пациентов ПОВГ, перенесших аутопластическую и аллопластическую герниопластику, в динамике показатели иммунологической реактивности достоверно повысились на седьмые сутки, в сравнении с исходными показателями крови. А именно у пациентов, перенесших аутопластические способы герниопластики, в отличие от аллопластических способов операции, которым применяли полипропиленовые сетчатые протезы. Использование обычных шовных материалов при аутогерниопластике увеличивает риск развития воспалительного процесса в раннем и отдаленном послеоперационном периоде.
Данное исследование доказало, что динамика показателей иммунологической реактивности и иммунного ответа на произведенную операцию выше у пациентов, которым применена аутогерниопластика. А при аллогерниопластике с применением полипропиленовых сетчатых протезов никак не влияют на здоровье пациента, а только улучшают показатели качества жизни, что дает возможно широкого его использования в области современной герниологии.
Библиографическая ссылка
Мамакеев К.М., Айтиев У.А., Динлосан О.Р., Ибраимов Б.А., Орозобеков Б.К., Турдалиев С., Рысбек уулу Залкарбек КЛИНИКО-ИММУНОЛОГИЧЕСКИЕ ПАРАЛЛЕЛИ У БОЛЬНЫХ C ПОСЛЕОПЕРАЦИОННЫМИ ВЕНТРАЛЬНЫМИ ГРЫЖАМИ // Научное обозрение. Медицинские науки. 2022. № 4. С. 21-25;URL: https://science-medicine.ru/ru/article/view?id=1266 (дата обращения: 23.02.2026).
DOI: https://doi.org/10.17513/srms.1266
 science-review.ru
science-review.ru