Гипоксия является типическим патологическим процессом. Нарушения, лежащие в ее основе, присущи многим заболеваниям, независимо от того, какие причины их вызвали. При этом известно, что гипоксия сопровождается развитием защитно-приспособительных процессов, которые активируются не только при патологии, но и при тренировке, к гипоксическим нагрузкам. Это связано с тем, что кислород необходим организму. Функций кислорода в организме много, но главной его задачей является поддержание жизни за счет преобразования энергии в клетках, идущей на выполнение функций различных структур и поддержание морфологической целостности организма. Современный уровень знаний в этой области сделал качественный скачок в понимании закономерностей компенсаторных механизмов по поддержанию необходимого уровня кислорода в организме [1]. Сведения, полученные к настоящему времени, позволяют понять, что происходит на молекулярном уровне не только при развитии гипоксии, но и при нарушении регуляции сосудистого тонуса, ангиогенеза, клеточной пролиферации и дифференцировки, апоптоза, липогенеза, иммуногенеза [2]. И этот список продолжает расширяться.
Цель исследования – провести анализ литературных источников, посвященных вопросу изучения физиологических и молекулярных изменений в клетках при низком содержании кислорода в организме, а также адаптационных реакций клеток на гипоксическое воздействие.
Задачи:
1) изучить полученные результаты исследований по ранее выявленным механизмам адаптации клеток в условиях гипоксии;
2) изучить роль белка HIF-1α (hypoxia-inducing factor) в механизмах адаптации к гипоксии и проанализировать его место в цепочке развития адаптационного механизма.
Материалы и методы исследования
Проведен анализ научных публикаций и исследовательских работ по запросам: «гипоксия», «механизмы адаптации организма к кислородному голоданию», «состояние клеток организма при пониженном уровне кислорода в крови» в базах данных PubMed, eLibrary, Cyberleninka и через обычный поиск браузера на русском языке.
При первичном запросе системой было предложено несколько научных источников, в которых рассматривались вопросы гипоксии и молекулярных особенностей адаптации клеток к низкому уровню кислорода в организме.
После изучения абстрактов было оставлено для анализа молекулярных особенностей адаптации клеток при гипоксических состояниях 6 источников, которые в наибольшей степени отвечали задачам настоящего исследования. Однако в дальнейшей работе список существенно расширился.
При написании статьи были использованы:
1. Теоретические методы (анализ, обобщение, систематизация научных положений и статей).
2. Эмпирические (изучение и обобщение клинического опыта, анализ результатов исследований).
Результаты исследования и их обсуждение
Детальное изучение механизмов адаптации клеток в ситуациях, когда концентрация жизненно важного уровня кислорода в организме снижается, позволило открыть гормон эритропоэтин [3]. Именно этот гормон дает сигнал, который служит отправной точкой для начала интенсивного образования красных кровяных телец [4]. В свою очередь, эритроциты, содержащие гемоглобин, транспортируют кислород в органы и ткани.
Однако долгое время не был изучен вопрос, как именно и за счет какого молекулярного механизма происходит выброс эритропоэтина почками в условиях кислородного голодания организма?
В 1990-х гг., при изучении реакции клеток на кислородное голодание и выделение эритропоэтина почками на молекулярном уровне, было открыто вещество, которое назвали HIF-1α (hypoxia-inducing factor). HIF-1α оказался белком, являющимся посредником между накоплением кислорода и экспрессией эритропоэтина. Помимо этого, на данный момент обнаружено несколько пептидных медиаторов, способных в условиях нормоксии вызывать подъем концентрации HIF-1α, а также ускорять связывание HIF-1α с ДНК [1].
Другой задачей в этих исследованиях было выявление роли HIF-1α при патологических состояниях, возникающих вследствие кислородного голодания, в частности при ишемии и последующем развитии онкологических заболеваний [5].
M. Ivan et. al. [6] обнаружили, что при нормальном содержании кислорода и при отсутствии активности HIF-1α организм начинает вырабатывать вещества, способные уничтожать данный белок. При этом, если организму не удалось полностью удалить данный белок, он становится способным накапливаться в избыточных количествах и оказывать неблагоприятное воздействие на организм, вызывая развитие опухолей. Данный вывод удалось сделать при изучении особенностей развития болезни Гиппеля – Линдау, которая является частой причиной онкологических процессов [7].
В это же время G.L. Semenza et. al. [1], также изучавшие механизм геномной перестройки продукции эритропоэтина при кислородном голодании, выявили дефект в процессе образования эритропоэтина и нарушение взаимодействия белка HIF-1α с ДНК. В частности, было выяснено, что при развитии гипоксии в цепочке событий, направленных на усиление продукции эритропоэтина, может не хватать звена, которое было необходимо для передачи информации о падении концентрации кислорода. Спустя некоторое время был выявлен еще один белок – VHL (Von Hippel – Lindau, другое название – опухолевый супрессор VHL). Именно он, при падении концентрации кислорода, начинает вырабатываться и взаимодействовать с HIF-1α, который, в свою очередь, уже дает сигнал биологически активным веществам почек вырабатывать эритропоэтин [6].
Данное открытие стало прорывом в области изучения патологических состояний организма, связанных с кислородным голоданием. Но выявилась новая проблема: каким образом уровень кислорода в организме дает сигнал для выработки VHL и связывания с HIF-1α?
P. Jaakkola et. al. [7] смогли выявить молекулярный субстрат, который способен давать сигнал для соединения белка VHL и HIF-1α при определенных показателях содержания кислорода в организме. При нормальном уровне кислорода гидроксильные молекулы находятся в конкретных позициях, HIF1α связывает VHL через два гидроксилированных остатка пролина. Это приводит к его деградации через протеасомы. Но, когда кислорода становится меньше, остатки пролина не гидроксилируются и VHL не может связываться с HIF1α. HIF1α вызывает транскрипцию генов, содержащих элемент ответа на гипоксию.
Когда уровень кислорода низкий (гипоксия) (рисунок), HIF-1α защищен от деградации и накапливается в ядре, где он связывается с ARNT и связывается со специфическими последовательностями ДНК (HRE) в генах, регулируемых гипоксией (1). При нормальном уровне кислорода HIF-1α быстро разлагается протеасомой (2). Кислород регулирует процесс деградации путем добавления гидроксильных групп (ОН) к HIF-1α (3). Затем белок VHL может распознавать и образовывать комплекс с HIF-1α, что приводит к его деградации в зависимости от содержания кислорода (4) [6].
Таким образом, в настоящее время известно, что увеличение уровня HIF-1α приводит к повышению экспрессии генов, которые обеспечивают адаптацию клетки к гипоксии и стимулируют выработку эритропоэтина, а также ангиогенез (за счет активации гена фактора роста эндотелия сосудов – VEGF), ферменты гликолиза (активация генов альдолазы, лактатдегидрогеназы, фосфофруктокиназы, пируваткиназы и пр.). Кроме того, HIF-1 регулирует экспрессию генов, участвующих в обмене железа, регуляции сосудистого тонуса, клеточной пролиферации, апоптоза, липогенеза. Показано, что HIF-1 причастен к формированию каротидных клубочков, развитию B-лимфоцитов и многим другим процессам [2, 8]. Из сказанного явствует, что HIF-1α причастен не только к реакции клеток на непосредственно гипоксическое воздействие, но и участвует в других процессах, которые непосредственно не связаны с развитием гипоксии (апоптоз, регенерация, ангиогенез, дифференцировка, иммуногенез, регуляция метаболизма и др.).
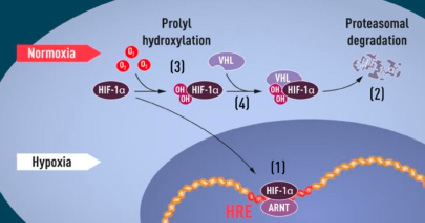
Белок HIF-1α в цепочке развития приспособления клеток в условиях гипоксии [6]
Было показано, что синтез HIF-1α может осуществляться как кислород-зависимым, так и кислород-независимым путем. Известно, что HIF-1α синтезируется в реакциях, контролируемых сигнальной системой MAPK (mitogen activated proteinkinase – активируется на сигналы, способствующие пролиферации) и системой PI3K (фосфатидилинозитол-3-киназа – регуляторный белок, связанный с различными сигнальными путями и важнейшие функции клетки, особое значение он имеет в регуляции роста, выживаемости, старения, опухолевого роста) [9]. Столь широкий диапазон влияний HIF-1α на процессы, казалось бы, не связанные с кислородным голоданием, но имеющие жизненное значение, побуждает искать точки соприкосновения между ними. Можно предположить, что такой точкой может оказаться энергообеспечение или энергодефицит клеток, поскольку энергодефицит может возникнуть как на фоне гипоксии, так и на фоне нормоксии. Данное предположение не лишено смысла, так как было показано, что HIF-1α, стабилизированный в условиях гипоксии, активирует несколько генов, контролирующих синтез ферментов гликолиза (альдолаза, пируваткиназа и др.), которые обеспечивают анаэробный синтез АТФ [9]. Однако данный вопрос требует дальнейшего исследования [10]. Иллюстрацией широкой вовлеченности HIF-1α в различные патологические процессы являются данные о его участии в процессах воспаления [11]. Было показано, что образование HIF-1α инициируется при воспалении, а с другой стороны, HIF-1α может потенцировать воспаление. Активацию HIF-1α связывают с развивающимися в условиях воспаления микроциркуляторными нарушениями, которые могут привести к развитию гипоксии. Но активация HIF-1α может быть связана и с «негипоксическими» воздействиями: изменением метаболизма иммунных клеток, синтезом провоспалительных медиаторов, которые способны напрямую инициировать активность HIF-1α. При локальном воспалении активация HIF-1α приводит главным образом к противовоспалительным эффектам, напротив, при системной воспалительной реакции – к провоспалительным. Все это свидетельствует о глубокой и сложной вовлеченности HIF-1α в процессы поддержания гомеостаза клетки.
Известно, что нарушение образования и деградация HIF-1α может лежать в развитии многих заболеваний (онкологических, сердечно-сосудистых заболеваний, ревматических и др.). В этой связи поиск лекарственных средств, способных повлиять на систему HIF-1α, может привести к появлению эффективных препаратов, способных улучшить контроль воспалительных процессов, расстройств иммунитета, злокачественного роста, а не только на направленное регулирование процессов срочной и долговременной адаптации организма к гипоксии. Активаторы HIF-1α могут быть эффективными для стимуляции заживления ран, ожогов, регенерации костной ткани после переломов, в лечении хронических анемий [8]. Изучение влияния известных в настоящее время препаратов, которые относятся к антигипоксантам, на уровень HIF-1α может изменить представления об их фармакодинамике и сформировать новые показания к их применению. Кроме того, можно предположить, что лекарственные средства в зависимости от дозы, схемы применения могут по-разному влиять на уровень HIF-1α. В результате это может привести к проявлению у них антигипоксических свойств. Но при других режимах применения они могут, напротив, выступая в качестве гипоксантов, вызывать повышение резистентности организма к последующему гипоксическому воздействию [12].
Еще одной важной проблемой является выяснение взаимосвязи HIF-1α и гипоксии у плода и новорожденных. Прежде всего, проблема сводится к пониманию возможности диагностики данных гипоксических состояний на основе определения содержания HIF-1α и того, каким образом можно воздействовать на белок HIF-1α для предотвращения кислородного голодания у новорожденных и насколько это целесообразно [13]. При диагностике гипоксических состояний у плода в основном опираются на методы, которые базируются на оценке косвенных признаков гипоксии (кардиотокография, электрокардиография плода, допплерометрия, определении содержания лактата, рН и других показателей кислотно-основного состояния и проч.). Данные об их эффективности, чувствительности и специфичности по-прежнему считаются достаточно противоречивыми [14]. Оценка содержания белка HIF-1α могла бы послужить кислородным сенсором, который дает непосредственную информацию об изменении кислородного бюджета в клетке. Что касается роли белка HIF-1α в развитии гипоксии плода, то необходимо отметить, что при гипоксии происходит усиление инвазии клеток трофобласта, которые мигрируют в окружающие эндометрий кровеносные сосуды. А способность трофобласта к инвазии, в частности, регулируется уровнем экспрессии гена HIF-1α [13]. Нарушение функционирования системы HIF может привести к ранней потере беременности. Кроме того, эритропоэз плода регулируется факторами роста (прежде всего, эритропоэтином), вырабатываемыми плодом, а не матерью. Они не проникают через плаценту. Стимулирование выработки материнского эритропоэтина не усиливает эритропоэз плода, и, наоборот, подавление материнского эритропоэза путем гипертрансфузии не подавляет эритропоэз плода. Таким образом, активность HIF-1α, с одной стороны, может иметь отношение к началу формирования плода, а с другой, может иметь отношение к патогенезу гипоксии плода. На этом фоне оценка экспрессии HIF-1α, а также поиски терапевтических влияний на активность HIF-1α могут оказаться продуктивными.
Заключение
Открытие HIF-1α позволило существенно детализировать механизмы адаптации клеток к гипоксическому воздействию. Исследование механизмов влияния HIF-1 на регуляцию экспрессии генов позволило определить его причастность к процессам обмена железа, регуляции сосудистого тонуса, клеточной пролиферации, апоптоза, липогенеза, иммуногенеза, воспаления, онкогенеза. Это существенно расширило наши представления о механизмах этих процессов. А также привело к пониманию того, что можно проводить патогенетическую коррекцию метаболических и морфофункциональных изменений при разнообразной патологии с помощью лекарственных средств, мишенью действия для которых является HIF-1α. Однако на данный момент необходимо понимать, что использование таких средств в достаточной мере затруднено в силу того, что HIF-система является сложной многофункциональной, многоуровневой, с перекрестным взаимодействием с другими сигнальными системами организма. Как стимуляция, так и подавление HIF-1α может оказаться как позитивными, так и негативными, так и безразличными в терапевтическом плане, так как многое в патогенезе конкретного заболевания будет определяться направленностью нарушений действия HIF-1α.
Библиографическая ссылка
Попугайло М.В., Дьячкова А.Д. ОТКРЫТИЕ МЕХАНИЗМА АДАПТАЦИИ КЛЕТОК К НЕДОСТАТКУ КИСЛОРОДА // Научное обозрение. Медицинские науки. 2022. № 6. С. 101-105;URL: https://science-medicine.ru/ru/article/view?id=1311 (дата обращения: 22.02.2026).
DOI: https://doi.org/10.17513/srms.1311
 science-review.ru
science-review.ru