Боль среди всех жалоб пациентов является наиболее частой причиной обращения в больницу. Она определяет качество жизни и трудоспособность человека. А ее отрицательное влияние отражается не только на самих пациентах, но и на их родственниках. По данным Всемирной организации здравоохранения (ВОЗ), ежедневно до 3,5 млн чел. страдают от боли, причем у 50 % – боль умеренная, у 30 % – непереносимая [1].
Международная ассоциация по изучению боли (The International Association for the Study of Pain (IASP)) предложила следующее определение слову «боль»: «Боль – это неприятное ощущение и эмоциональное переживание, связанное с повреждением тканей или описываемое человеком в терминах такого повреждения».
Боль – это сложная защитная реакция, которая сигнализирует о повреждении или угрозе организму и создает мотивацию избавиться от факторов, которые ее вызывают. Но наряду с полезной функцией это имеет и негативные последствия. Поэтому после определения причины боли их следует прекратить. Чувство боли отличается от других чувств тем, что оно не несет информации об окружающем мире и всегда имеет негативную эмоциональную окраску. А слишком длительная или сильная боль может привести к дезадаптации организма [2]. Кроме того, если острый болевой синдром не купировать, существует риск того, что он перерастет в хронический. И хотя боль крайне субъективна, боль сопровождается объективными изменениями в организме (повышением артериального давления, частоты дыхания и сердечных сокращений, расширением зрачков, повышением потоотделения и концентрации глюкозы в крови, снижением секреции желез желудочно-кишечного тракта) [3].
Цель исследования – изучить роль антиноцицептивной системы в обезболивании и механизмы облегчения восприятия болевых сигналов анальгезирующими средствами.
Методы исследования – систематический анализ, обобщение данных литературы за период с 1991 по 2021 г.
Для ограничения чувства боли в организме человека функционирует антиноцицептивная система, представляющая собой комплекс структур, расположенных на различных уровнях центральной нервной системы (ЦНС). Выделяют сегментарный и центральный уровни контроля, а также гуморальные механизмы. Возникновение боли связано с недостаточностью антиноцицептивной системы. Так, если антиноцицептивная система не справляется со сверхсильными болевыми эффектами, то есть вероятность развития болевого шока. А при снижении тормозного эффекта антиболевой системы ноцицептивная система перевозбуждается и может вызывать ощущение спонтанной психогенной боли даже в здоровых органах и тканях [4].
Антиноцицептивная система функционирует на нескольких уровнях: стволовом, гипоталамическом и корковом (рис. 1).
Стволовой уровень. Представлен центральным серым околоводопроводным веществом (ЦСОВ) и ядром шва (ЯШ), которые представляют собой единую функциональную систему посредством аксонов, которые влияют на соответствующие нейроны-мишени. Серотонин, выделяется большинством окончаний этих аксонов, подавляет активность релейных нейронов, которые получают информацию о боли с периферии, и вызывает возбуждение на энкефалинергических нейронах, находящихся рядом со вставочными. Вовлечение энкефалинергических нейронов активирует механизмы пост- и пресинаптического торможения вставочных нейронов [5, 6]. Таким образом, удлиняется время тормозного состояния релейных нейронов и формируется барьер, препятствующий прохождению болевой импульсации.
Кроме того, антиноцицептивные механизмы стволового уровня включают ПГЯ и голубое пятно (ГП). Наибольшее количество аксонов нейронов этих образований расположено там, где расположены чувствительные ядра тройничного нерва и в задних рогах спинного мозга.
Стимуляция ПГЯ и ГП способна уменьшать силу болевых импульсов от сенсорных ядер тройничного нерва. Данный механизм угнетения импульсации осуществляется с помощью энкефалинергических (ПГЯ) и норадренергических (ГП) воздействий на рецепторы соматической мембраны вставочных нейронов и мембраны пресинаптических С-волокон. По сравнению с подавлением за счет ЦСОВ-ЯШ, этот механизм обладает большей избирательностью, не блокируя импульсы безболезненного характера.
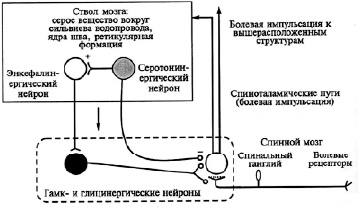
Рис. 1. Взаимодействие основных элементов обезболивающей системы организма первого уровня: ствол мозга – спинной мозг (В.М. Смирнова, 2012 г.) Нейроны: светлые – возбуждающие, черный – тормозной, (+) возбуждение, (-) торможение
Из-за быстрого увеличения интенсивности восходящего болевого потока в таламус активируются механизмы антиноцицептивной системы на стволовом уровне. Передаваемые по коллатералям волокон спинно-таламического и тригемино-таламического трактов, болевые импульсы возбуждают нейроны гигантоклеточного ядра ретикулярной формации и они активируют практически весь комплекс стволовых антиноцицептивных механизмов в составе ЦСОВ, ЯШ, ГП. В результате активируются нисходящие механизмы торможения поступления болевых импульсов в центральную нервную систему.
Гипоталамический уровень. В центральной нервной системе выделяют зоны положительного и отрицательного подкреплений, активация которых вызывает различные состояния, имеющие эмоциональную окраску (Дж. Олдс) [7]. Было обнаружено, что стимуляция гипоталамической зоны положительного подкрепления (дорсомедиальное ядро) вызывает уменьшение боли. Это происходит, во-первых, за счет энкефалинергических воздействий, повышающих активность антиноцицептивных механизмов стволового уровня, во вторых, за счет бета-эндорфинергических влияний, снижающих скорость прохождения болевой импульсации через неспецифические ядра таламуса [7].
Стимуляция гипоталамической зоны отрицательного подкрепления (вентромедиальное ядро гипоталамуса) и стрессовые состояния (состояния страха, агрессии, печали) сопровождаются уменьшением болевых ощущений. Ведущей ролью в возникновении гипоалгезии обладают норадреналинергические и дофаминергические нейроны гипоталамуса, которые контролируют антиноцицептивные механизмы на уровне ствола, связанные с активностью ПГЯ и ГП. Повышение адренокортикотропного гормона (АКТГ) в крови, всегда отмечаемое при стрессе, сопровождается параллельной активацией клеток передней доли гипофиза и выбросом бета-эндорфина (Ф. Блюм) [8]. Бета-эндорфин вторично оказывает подавляющее действие на активность ноцицепторов и на нейроны всех каналов передачи болевых импульсов в ЦНС [6]. Таким образом, состояние гипоалгезии продлевается (рис. 2).
Корковый уровень. Нисходящие волокна коркового контроля болевой чувствительности, идущие к задним рогам спинного мозга и сенсорным ядрам тройничного нерва, начинаются в различных областях моторной, орбитальной коры, в полях SI, SII. Кортикофугальное воздействие на нейроны может быть активизирующим, но преобладают пре- и постсинаптические ингибирующие эффекты, особенно на нейроны, контактирующие с афферентами С-типа. Также помимо прямого воздействия на нейроны спинного мозга и тройничного нерва, поле SII контролирует их влияние опосредованно, модулируя возбуждение стволового комплекса антиноцицептивной системы [9].
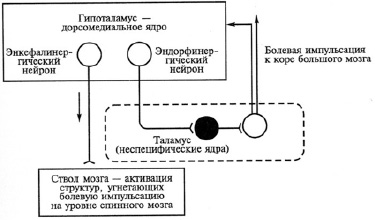
Рис. 2. Механизм работы антиноцицептивной системы организма второго уровня с помощью опиоидов (гипоталамус – таламус – ствол мозга) (В.М. Смирнова, 2012 г.) Нейроны: светлые – возбуждающие, черный – тормозной
Моторные и соматосенсорные поля коры головного мозга контролируют афферентные импульсы, направляющиеся через таламус и гипоталамус. Главную роль в обеспечении кортико-гипоталамических эффектов играет лобная кора. Ее воздействие всегда зависит от функционального состояния организма: в одних случаях активность ядер, участвующих в обработке болевой импульсации повышается, в других она подавляется. Например, в опытах по выработке пищевого условного рефлекса у собак на болевой условный сигнал (И.П. Павлов) доказывается корковая коррекция реагирования организма в процессе модуляции ядер гипоталамуса [10]. Вследствие реакции на боль у собаки наблюдалось возбуждение гипоталамических эмоциогенных центров, в виде учащенного дыхания, голосовых реакций, генерализованных движений. Но в дальнейшем эта реакция исчезала и в ответ на болевой раздражитель происходило выделение слюны [10].
Таким образом, механизм работы антиболевой системы заключается в выделении биологически активных эндогенных опиоидных веществ (эндорфины, энкефалины, динорфины) и связывании их с рецепторами ноцицептивной системы. В результате возникает пре- или постсинаптическое торможение в нейронах болевой системы. Кроме того, в регуляции болевых ощущений участвуют и неопиоидные пептиды, например, нейротензин. Так же боль могут подавлять серотонин и катехоламины (норадреналин, адреналин, дофамин).
Хотя в организме постоянно функционирует антиноцицептивная система, ее эндогенных биологически активных веществ (БАВ) недостаточно, чтобы полностью ограничить человека от боли. Поэтому на фармакологическом рынке одну из лидирующих позиций занимают обезболивающие препараты, стимулирующие активность антиноцицептивной системы, усиливая торможение проведения боли и уменьшая ее эмоциональное проявление.
Анальгетические средства, или анальгетики (от греч. algos – боль и an – без), представляют собой лекарственные средства резорбтивного действия, обладающие специфической способностью уменьшать или устранять ощущение боли. Есть и другие вещества, принадлежащие к разным фармакологическим группам, обладающие теми же свойствами. Например, препараты для наркоза и местные анестетики. Но анальгетики отличаются от них тем, что в терапевтических дозах не вызывают потери сознания, не угнетают другие виды чувствительности (температурную, тактильную и др.) и не нарушают двигательные функции [11].
Сегодня по механизмам фармакологической активности выделяют две основные группы анальгетиков:
− Опиоидные (наркотические) анальгетики.
− Ненаркотические анальгетики.
Опиоидные (наркотические) анальгетики. К ним относятся: морфин, кодеин, фентанил, трамадол, промедол и другие. Так как они, так же как молекулы энкефалинов и эндорфинов, имеют тирозиновый остаток, следовательно, они способны взаимодействовать с опиоидными рецепторами антиноцицептивной системы. Таким образом, оказывают анальгетическое действие без потери сознания и подавления других видов чувствительности. Также опиоидные анальгетики имеют способность связываться с энкефалиназами (ферменты, которые разрушают энкефалины) и, следовательно, повышать уровень этих медиаторов в крови.
К основным механизмам обезболивающего действия опиоидных анальгетиков относятся:
− повышение тормозного эффекта нисходящей антиноцицептивной системы на проведение болевой импульсации в афферентных путях ЦНС (снижается нейрональный захват серотонина в нисходящих путях);
− подавление болевых импульсов в афферентных путях ЦНС (нарушается передача импульсов с окончаний первичных афферентных нейронов на задние рога спинного мозга);
− изменение (извращение) эмоциональной оценки боли.
Из-за стимуляции пресинаптических опиоидных рецепторов, расположенных на концах первичных афферентных нейронов, высвобождение субстанции Р уменьшается, при этом нарушается передача болевой импульсации к вставочным нейронам задних рогов спинного мозга. В итоге возбуждения постсинаптических опиоидных рецепторов нарушается процесс деполяризации постсинаптической мембраны и ингибируется активация вставочных нейронов благодаря действию медиатора. В результате проявляется спинальное действие анальгетиков (нарушается передача болевых импульсов на уровне спинного мозга) [12].
При стимуляции опиоидных рецепторов в сером околоводопроводном веществе активируется нисходящая антиноцицептивная система, которая оказывает тормозное воздействие на проведение болевых импульсов по афферентным путям спинного мозга (супраспинальное действие). Нисходящие тормозные эффекты осуществляются посредством серотонина и норадреналина.
Наркотические анальгетики, воздействуя на высшие отделы ЦНС, изменяют эмоциональную оценку боли, снижают ее восприятие, следовательно, повышают порог болевой чувствительности.
Наркотические анальгетики обладают разными психотропными эффектами благодаря тому, что опиатные рецепторы находятся не только на болевых путях, но и в коре головного мозга, гипоталамусе, миндалине и других отделах головного мозга. Так, например, могут наблюдаться выраженная седация, эйфория, галлюцинации. Все они в результате приводят к подавлению эмоционально негативных проявлений боли. Эйфория является одной из главных причин развития зависимости и наркомании. Наркотические анальгетики вызывают привыкание и абстинентные синдромы (активируют описанные рецепторы и по принципу обратной связи тормозится выработка эндогенных пептидов). Это ограничивает применение опиоидных анальгетиков в клинической практике [12].
Ненаркотические анальгетики, в отличие от наркотических средств, не вызывают эйфории и наркотической зависимости. Способны оказывать не только обезболивающее, но и значительное противовоспалительное и жаропонижающее действие, в отличие от опиоидных анальгетических препаратов. Применяются при мигренях, болях, связанных с воспалением (суставная боль при ревматизме). Неэффективны при послеоперационных болях и болях, вызванных мышечными судорогами, вздутием живота, вследствие менее выраженного обезболивающего действия в отличие от наркотических средств. К этой группе ненаркотических анальгетиков относятся: ибупрофен, кетопрофен, парацетамол, ацетилсалициловая кислота, напроксен и другие.
Воспаление – местная тканевая защитная реакция организма, появляющаяся в ответ на повреждение. Проявляется следующими признаками: покраснением (rubor), отеком (tumor), болью (dolor), повышением температуры (calor) и нарушением функций (functio laesa).
Благодаря ингибированию активности ключевого фермента циклооксигеназы (ЦОГ) для синтеза медиаторов воспаления простагландинов (ПГ) проявляется противовоспалительный эффект ненаркотических анальгетиков. Прекращение синтеза ПГ уменьшает высвобождение других тканевых медиаторов воспаления (норадреналин, гистамин, брадикинин, серотонин), что ведет к подавлению вызываемых ими проявлений воспаления [2, 13].
Анальгетический эффект ненаркотических препаратов связан с прекращением возникновения болевых импульсов в окончаниях чувствительных нейронов (при воспалении боль возникает благодаря образованию и накоплению в тканях медиаторов воспаления, которые раздражают окончания нейронов и вызывают болевую импульсацию). Данная группа медицинских препаратов обладает способностью уменьшать образование медиаторов воспаления и, следовательно, предотвращает возникновение боли. За счет снижения уровня ПГ в структурах головного мозга угнетается передача болевых сигналов по восходящим путям спинного мозга, увеличивается синтез эндорфинов [14].
Жаропонижающий эффект связан с ингибированием синтеза ПГ, которые, воздействуя на гипоталамус, возбуждают центр терморегуляции. В то же время теплоотдача увеличивается за счет вазодилатации и усиления потоотделения. Так как простагландины не участвуют в поддержании нормальной температуры тела, то жаропонижающий эффект ненаркотических анальгетиков проявляется только при повышенной температуре тела.
Заключение
Восприятие боли зависит от силы болевого воздействия и от состояния ноцицептивной и антиноцицептивной систем. Болевая чувствительность увеличивается при повышении активности болевой или снижении противоболевой систем. Вследствие того, что сильная и продолжительная боль способна вызвать нарушение работы жизненно важных систем организма (вплоть до развития шока), а также имеет отрицательное влияние на эмоциональное состояние человека, то в медицинской практике используются анальгезирующие средства. Наркотические анальгетики облегчают любую боль, ненаркотические – в основном подавляют болевые ощущения, связанные с воспалением.
Библиографическая ссылка
Чагина Е.А., Бурая В.Ю. ПАТОГЕНЕТИЧЕСКАЯ РОЛЬ АНТИНОЦИЦЕПТИВНОЙ СИСТЕМЫ В МЕХАНИЗМАХ ОБЛЕГЧЕНИЯ ВОСПРИЯТИЯ БОЛЕВЫХ СИГНАЛОВ И МЕХАНИЗМЫ АНАЛЬГЕТИЧЕСКОГО ОБЕЗБОЛИВАНИЯ // Научное обозрение. Медицинские науки. 2023. № 1. С. 43-48;URL: https://science-medicine.ru/ru/article/view?id=1319 (дата обращения: 21.02.2026).
DOI: https://doi.org/10.17513/srms.1319
 science-review.ru
science-review.ru