Одной из причин внебольничных пневмоний являются вирусные инфекции. Особое значение среди них имеют вирусы гриппа, вызывающие через каждые 1–3 года эпидемии, а антигенная изменчивость вирусов гриппа А примерно раз в 10–40 лет обуславливает возникновение пандемий и высокую летальность от пневмоний.
Так, в 2009 г. человечество столкнулось с первой в XXI столетии пандемией, вызванной новым вариантом вируса гриппа АH1N1 swin – тройным реассортантом, сочетающим сегменты РНК, от штаммов гриппа человека, свиней и птиц. На фоне пандемии новой коронавирусной инфекции COVID-19 в 2020 г. отмечен значительный рост заболеваемости и смертности от внебольничных пневмоний [1, 2].
Согласно данным официальной статистики, заболеваемость внебольничными пневмониями в Российской Федерации в 2021 г. составила 1150,4 на 100 тыс. взрослого населения, отмечен рост заболеваемости в 3 раза по сравнению с 2014 г. В Тульской области в 2021 г. заболеваемость ВП превышает показатели заболеваемости по РФ в 1,3 раза. Наблюдается рост заболеваемости внебольничными пневмониями в 2021 г. в 3,6 раза по сравнению с 2014 г. (рис. 1).
Среди потенциальных возбудителей внебольничных пневмоний встречается более 100 микроорганизмов (бактерии, вирусы, грибы, простейшие). Большинство случаев заболеваний ВП ассоциируется с небольшим кругом патогенов: S. pneumoniae, S. aureus, M. pneumoniae, Cl. pneumoniae, H. influenzae, энтеробактерии, L. pneumophila. В последние годы доказана роль многочисленных респираторных вирусов. Наиболее часто встречаются вирусы гриппа, коронавирусы, парагриппа, аденовирусы, респираторно-синцитиальные (РС) вирусы [3, 4].
В среднем у 7 % госпитализированных пациентов с COVID-19 была выявлена бактериальная нозокомиальная инфекция. У пациентов, проходивших лечение в отделениях интенсивной терапии, этот процент увеличивался в 2 раза [1, 2].
Несмотря на невысокий процент, присоединение бактериальной инфекции к вирусной, часто определяет неблагоприятный исход заболевания. Тяжелое течение новой коронавирусной инфекции как минимум в 5 % случаев требует оказания неотложной помощи в отделении интенсивной терапии. Как известно, пациенты этих отделений подвержены высокому риску развития нозокомиальных инфекций. Осложняет ситуацию и характер используемых при коронавирусной инфекции методов лечения искусственная вентиляция легких [5].
Цель исследования – сравнительная характеристика этиологической структуры микробного пейзажа проб мокроты больных с внебольничной пневмонией в «доковидный» период и во время пандемии COVID-19, а также динамики антибиотикорезистентности наиболее часто встречаемых видов микроорганизмов.
Материалы и методы исследования
Материалом исследования была мокрота, полученная от пациентов, возраст которых 18 лет и старше, находящихся на лечении в инфекционном стационаре г. Тулы в эпидсезон вирусных инфекций 2017–2018 гг. и в эпидсезон новой коронавирусной инфекции 2020–2021 гг. с диагнозом внебольничная пневмония. Для сравнения пациенты были разделены на две группы: первая – пациенты, у которых был подтвержден диагноз COVID-19 методом ПЦР в 2020–2021 гг. («ковидный» период); вторая – пациенты с диагнозом грипп, ОРВИ в 2017–2018 гг. («доковидный» период).
Исследование мокроты от больных проводили на базе городской централизованной диагностической бактериологической лаборатории ГУЗ «Тульская городская клиническая больница скорой медицинской помощи им. Д.Я. Ваныкина».
Для выделения чистой культуры микроорганизмов использовали бактериологический метод. Посев мокроты осуществляли на плотные искусственные питательные среды (кровяной агар, Эндо, Сабуро, желточно-солевой агар), проводили бактериоскопию с окраской мазка по Граму. Для идентификации возбудителя использовали биохимический метод с использованием сред Гисса и автоматический анализатор Vitek II Сompact (BioMérieux, Франция).
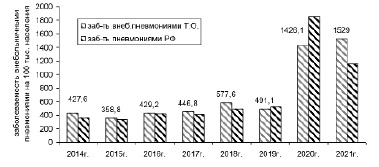
Рис. 1. Динамика заболеваемости внебольничными пневмониями
Чувствительность к антимикробным препаратам определялась диско-диффузионным методом на среде Мюллера – Хинтона, использовались диски производства НИЦФ, Санкт-Петербург, Россия, и с помощью автоматического анализатора Vitek II Сompact (BioMérieux, Франция).
Интерпретация результатов антибиотикочувствительности, механизмов резистентности основывалась на клинических рекомендациях 2020 г. «Определение чувствительности микроорганизмов к антимикробным препаратам», предлагаемых Европейским комитетом по определению чувствительности к антимикробным препаратам (European Committee on Antimicrobial Susceptibility Testing – EUCAST).
Результаты исследования и их обсуждение
При бактериологическом исследовании образцов мокроты, полученной от больных с COVID-19, были выделены культуры в 56,9 % случаев, в «доковидный» период – в 51,2 % случаев.
Среди обследуемых пациентов существенных различий по половому признаку не наблюдается. На долю мужского населения в «доковидный» период приходится 47 %, на долю женского – 53 %. В период пандемии COVID-19 – 46,5 и 53,5 % соответственно.
Характеристика возрастного состава представлена на рис. 2, 3.
В возрастной структуре в период пандемии COVID-19 заболеваемость внебольничными пневмониями увеличилась в 2 раза среди населения 51–60 лет, 71–80 лет; в возрасте 61–70 лет существенных различий не имеется.
В структуре выделенной бактериальной микрофлоры у больных новой коронавирусной инфекцией COVID-19 преобладают грибы Candida albicans – 39,5 %. На долю грамотрицательных микроорганизмов семейства Enterobacteriaceae приходится 30,6 %. На грамотрицательные неферментирующие микроорганизмы – 24,2 %, на грамположительную кокковую флору – 5,6 %. Среди штаммов грамотрицательных бактерий большая доля принадлежит Klebsiella pneumoniae – 35,3 %, на Acinetobacter baumannii приходится 28,9 %, Escerichia coli – 19,1 %, Pseudomonas aeruginosa – 8,9 %. Грамположительная флора была представлена в 2,4 % случаев Staphylococcus aureus, по 1 % Streptococcus pneumoniae, Staphylococcus spp., Streptococcus spp. соответственно (рис. 4).
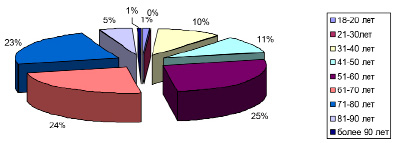
Рис. 2. Возрастная структура пациентов в период пандемии COVID-19
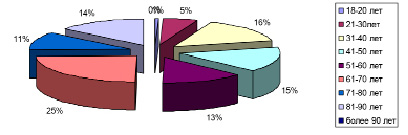
Рис. 3. Возрастная структура пациентов в «доковидный» период
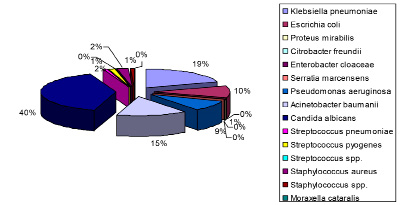
Рис. 4. Бактериальный пейзаж мокроты в период пандемии COVID-19
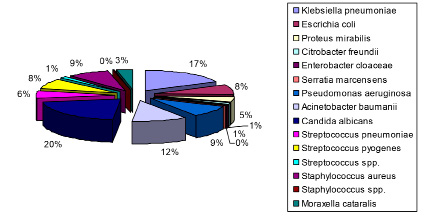
Рис. 5. Бактериальный пейзаж мокроты в «доковидный» период
В «доковидный» период в этиологической структуре внебольничных пневмоний преобладали микроорганизмы семейства Enterobacteriaceae, на долю которых приходится 31,7 %, второе место принадлежит кокковой флоре – 27,3 %, на долю грибов Candida albicans и неферментирующих грамотрицательных бактерий приходится 20,9 и 20,1 % соответственно. Среди штаммов грамотрицательных бактерий большая доля принадлежит Klebsiella pneumoniae – 34,0 %, на Acinetobacter baumannii приходится 22,2 %, Escerichia coli – 14,6 %, Pseudomonas aeruginosa – 16,7 %, Proteus mirabilis – 9,0 %. Среди грамположительной кокковой флоры на долю Staphylococcus aureus приходится 9 %, Streptococcus pneumoniae – 6 %, Streptococcus pyogenes – 8 %, Streptococcus spp. – 1 % (рис. 5).
При исследовании микрофлоры мокроты также были выявлены микробные ассоциации. В период пандемии новой коронавирусной инфекции микст-инфекции встречались в 10,5 %, в «доковидный» период – в 6,1 % случаев. В период пандемии COVID-19 встречались ассоциации грибов Candida albicans в сочетании с грамотрицательными микроорганизмами в 9,7 % случаев. В «доковидный» период микробные ассоциации грибов Candida albicans встречались в 1,4 % с грамположительной кокковой флорой и в 0,7 % случаев с грамотрицательной флорой.
В «доковидный» период 2017–2018 гг. наметился ряд негативных тенденций роста антибиотикорезистентности внебольничных штаммов грамотрицательных микроорганизмов у госпитальных больных – повышение резистентности к цефалоспоринам 3–4-го поколения, фторхинолонам, аминогликозидам, карбопенемам.
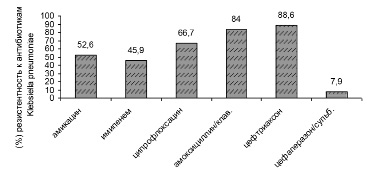
Рис. 6. Антибиотикорезистентность Klebsiella pneumoniae в «доковидный» период
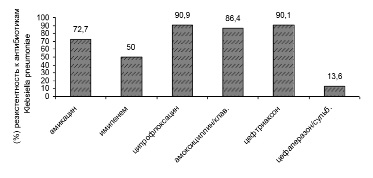
Рис. 7. Антибиотикорезистентность Klebsiella pneumoniae в период пандемии COVID-19
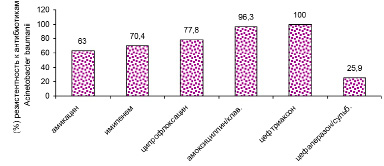
Рис. 8. Антибиотикорезистентность Acinetobacter baumanii в «доковидный» период
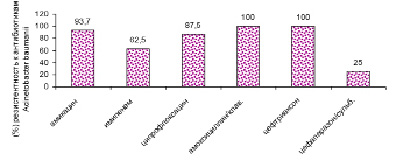
Рис. 9. Антибиотикорезистентность Acinetobacter baumanii в период пандемии COVID-19
В период пандемии COVID-19 в 2020–2021 гг. произошел рост антибиотикорезистентности у ряда выделенных штаммов микроорганизмов. У больных новой коронавирусной инфекцией выделяются полирезистентные штаммы Acinetobacter baumannii, Pseudomonas aeruginosa, Klebsiellае pneumoniae. Ацинетобактер, синегнойная палочка, клебсиелла сохранили чувствительность к антибиотику цефалоспоринового ряда: цефаперазон-сульбактаму. Klebsiellа pneumoniae оказалась резистентной к амоксициллин/клавуланату, ципрофлоксацину. Антибиотикорезистентность представлена на рис. 6–9.
Заключение
В этиологическом пейзаже пневмоний, развивающихся при COVID-19, в сравнении с внебольничными пневмониями, регистрируемыми в 2017–2018 гг., в период циркуляции вируса гриппа A H1N1pnd09, произошли существенные изменения.
В структуре выделенных микроорганизмов в период пандемии COVID-19 возросла доля грибов Candida albicans. Процент выделения грамотрицательных бактерий семейства Enterobacteriaceae практически не изменился. В группе больных с COVID-19 незначительно увеличился процент выделения грамотрицательных неферментирующих бактерий. Увеличение произошло за счет Acinetobacter baumannii. На его долю стало приходиться 15,3 % (11,5 %). Доля Pseudomonas aeruginosa практически не изменилась и составила 8,6 % (8,9 %).
В группе больных с COVID-19 произошло резкое снижение грамположительной кокковидной флоры. В «доковидный» период на ее долю приходилось 27,3 %, в период пандемии – 5,6 %. Уменьшилась доля выделения Streptococcus pneumoniae с 6 до 1 %, Staphylococcus aureus с 9 до 1 %, Streptococcus pyogenes с 8 до 1 %.
При изучении антибиотикорезистентности наметилась негативная динамика ее увеличения у грамотрицательных бактерий.
Таким образом, при лечении больных внебольничными пневмониями, вызванными возбудителем новой коронавирусной инфекции или других вирусных инфекций, осложненными присоединением бактериальной флоры, необходимо учитывать преобладание в этиологической структуре поражения нижних дыхательных путей грамотрицательных бактерий, высокий риск присоединения грибковой флоры и активации других условно-патогенных возбудителей.
Библиографическая ссылка
Смольянинова О.Л., Долгополова Е.А., Дешко И.В., Кишкина В.С. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА БАКТЕРИАЛЬНОЙ МИКРОФЛОРЫ, ВЫДЕЛЕННОЙ ИЗ МОКРОТЫ БОЛЬНЫХ ВНЕБОЛЬНИЧНОЙ ПНЕВМОНИЕЙ В «ДОКОВИДНЫЙ» ПЕРИОД И ВО ВРЕМЯ ПАНДЕМИИ COVID-19 В ТУЛЬСКОМ РЕГИОНЕ // Научное обозрение. Медицинские науки. 2023. № 2. С. 5-10;URL: https://science-medicine.ru/ru/article/view?id=1321 (дата обращения: 09.02.2026).
DOI: https://doi.org/10.17513/srms.1321
 science-review.ru
science-review.ru