В настоящее время для замещения дефектов костей свода черепа используют различные материалы искусственного и природного происхождения [1, 2]. Однако число неблагоприятных исходов при применении этих имплантатов превышает 20% [3]. Причинами неудачных исходов являются отторжение имплантата, требующее повторной операции, и инфицирование [4, 5]. При этом для имплантатов алло- и ксеногенного происхождения основными недостатками являются их низкая приживаемость и частое инфицирование [6]. У аутоимплантатов, которые относятся к наиболее приемлемому варианту, недостатком является их ранняя резорбция, не позволяющая сформировать в зоне повреждения регенерат [7]. Указанные обстоятельства приводят к необходимости модифицирования имплантатов, включая импрегнацию в их состав различных биологически активных веществ [8, 9]. Другим вариантом снижения числа неудачных исходов является разработка новых хирургических техник краниопластики [10, 11]. В этом направлении авторами ранее разработана технология замещения дефектов костей свода черепа (патент РФ на изобретение № 2069536) включающая, в том числе, возможность использования консервированных алло- и/или ксенотрансплантатов в качестве опоры для формирования в дефектах костей свода черепа дистракционного регенерата.
Цель настоящего исследования – оценка возможности применения технологии замещения дефектов костей свода черепа с использованием алло- и ксенотрансплантатов в качестве опоры для формирования дистракционного регенерата.
Материал и методы исследования
Эксперименты выполнены на 18 взрослых беспородных собаках обоего пола в возрасте 1,5–2 лет. Оперативное вмешательство выполняли в условиях операционной под общим обезболиванием. На голову собаки накладывали кольцо аппарата Илизарова, резецировали участок костей свода черепа слева или в центральной части свода и к заднему краю полученного дефекта подсоединяли костный трансплантат (алло- или ксеногенного происхождения), фиксируя его двумя тракционно-направляющими спицами, позволяющими удерживать в дефекте и дозированно перемещать трансплантат. Концы тракционно-направляющих спиц крепили на кольце в его каудальной и краниальной частях. Дефект костей свода черепа в среднем был равен 3,4х1,9 см, размеры трансплантатов – 1,3х1,6 см. Перемещение трансплантата (с помощью тракционной системы, устанавливаемой в передней части кольца) начинали через 14 дней после операции и осуществляли его с темпом 0,5 мм в сутки до замещения дефекта (длительность тракции составила 42 суток), после чего осуществляли фиксацию трансплантата. При формировании в дефекте полноценного регенерата тракционную систему демонтировали. В группе 1 (n=9) использовали трансплантат аллогенного происхождения, в группе 2 (n=9) – ксеногенного происхождения. Группу сравнения (контроля) не формировали, поскольку сравниваемых аналогов для разработанной технологии нет.
Заготовка, хранение и предоперационная обработка костных материалов. Аллогенный материал (бугристость большеберцовой кости) предварительно получали от беспородных собак в возрасте 1,5–2 лет, выведенных из ранее выполненных экспериментов. Ксеногенный материал (фрагменты мыщелков бедренной кости) получали от кроликов. После забора фрагменты костного материала очищали от мягких тканей и помещали в 10%-ный водный раствор формалина. Через 30 дней консервации материал переносили в 1%-ный водный раствор формалина и хранили при температуре 4–8°С до применения. Перед имплантацией материал в операционной отмывали от остатков формалина в 10-кратном объеме физиологического раствора в трех промывочных растворах.
Постоперационное наблюдение. В первые 3 суток после операции всем животным назначали антибиотики (пенициллин А) и нестероидное противовоспалительное средство кетопрофен (2 мг/кг, один раз в день). Антисептическую отработку мест входа и выхода спиц проводили 1%-ным спиртовым раствором хлоргексидина в течение всего периода дистракции. Животные содержались в виварии исследовательского центра, в боксах по одному. Влажную уборку клеток осуществляли ежедневно. Корм давали два раза в день (стандартный рацион вивария), питьевую воду – без ограничений. Перед поступлением в эксперимент животные проходили карантин в течение 30 суток. Все манипуляции с животными выполняли под премедикацией (димедрол 1%, 0,02 мг/кг, рометар 2%, 1 мг/кг). Эвтаназию животных осуществляли путем введения летальных доз барбитуратов после предварительной премедикации. Выводили из опыта по три собаки на 42-е сутки дистракции, после окончания фиксации и через 90 дней после снятия аппарата. На сроках послеоперационного периода выполняли рентгенологическое (свод черепа) исследование, после эвтаназии – гистологическое.
Рентгенографические исследования проводили 1 раз в неделю в течение первых 60 дней после операции, далее 1 раз в 2 недели. Рентгенографию выполняли на рентгеновском аппарате «Compact» (Италия).
Гистологические исследования. После забора аутопсийного материала для гистоморфологического исследования костные блоки фиксировали в 4%-ном нейтральном формалине, декальцинировали в смеси Рихмана–Гельфанда–Хилла и обезвоживали в спиртах возрастающей концентрации. После этого образцы уплотняли в парафине и микротомировали на микротоме HM 450 (Thermo Fisher Scientific, UK). Для светооптического исследования срезов применяли обзорное окрашивание гематоксилином и эозином.
На проведение исследования было получено одобрение локального этического комитета (протокол № 2(57) от 17.05.2018). Исследование проведено при соблюдении принципов гуманного обращения с лабораторными животными в соответствии с требованиями Европейской конвенции по защите позвоночных животных, используемых для экспериментов и других научных целей, и Директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22.09.2010 по охране животных, используемых в научных целях.
Количественные данные в таблице представлены в виде средней арифметической и стандартного отклонения (M±SD). Для оценки статистически значимых отличий между группами применяли W-критерий Вилкоксона. Минимальный уровень значимости принят равным при p<0,05.
Результаты исследования и их обсуждение
При замещении дефектов костей черепа с помощью аллотрансплантата на момент окончания тракции трансплантата (42-е сутки) отмечено образование регенерата длиной 0,5–1 мм по всему периметру дефекта. В диастазе были видны тени костного регенерата, отходящие от края дефекта и от трансплантата (рис. 1). При этом длина их была примерно равна. Между костными отделами имелась зона просветления шириной до 1 мм. Плотность регенерата была выше у краев дефекта.
Микроскопическими исследованиями установлено, что к этому сроку дистракционный регенерат состоял из двух костных отделов длиной 6–7 мм и узкой (1–1,5 мм) зоны соединительной ткани, заполнявшей также и вентральную часть диастаза и спаянной с твердой мозговой оболочкой. В участках регенерата, прилежащих к каудальному краю дефекта, грубоволокнистая кость перестраивалась в более зрелую пластинчатую. В центральной части регенерата остеогенез продолжался, о чем свидетельствовал слой функционирующих остеобластов на поверхности новообразованных трабекул. Высота (толщина) регенерата колебалась от 1 до 2,2 мм при высоте окружающей кости 3,2 мм.
На момент снятия аппарата (конец фиксации) аллотрансплантат, состоящий из губчатой кости, постепенно замещался новой костной тканью. Более активно этот процесс происходил в каудальной части трансплантата, где отмечались новообразование костного вещества на поверхности старых трабекул и рост костного регенерата в сторону диастаза. В костномозговых полостях содержались плазма, костный детрит, а также элементы крови. Рентгеноморфологическая картина регенерата в этот период практически не отличалась от описанной для срока окончания дистракции.
На 90-е сутки после снятия аппарата рентгенологически и морфологически в диастазе определялся костный регенерат, каудальная часть которого имела строение накладной кости черепа, т.е. состояла из двух компактных пластинок и диплоэ с жировым костным мозгом. В краниальной части новообразованная кость еще сохраняла грубоволокнистое строение, а на вентральной поверхности, обращенной к твердой мозговой оболочке, продолжался десмальный остеогенез. Трансплантат частично был замещен новообразованной костью (рис. 2). В диастазе наряду с костной тканью сохранялась фиброзная. В одном случае трансплантат, окруженный грануляционной тканью с обильной лейкоцитарной инфильтрацией, подвергался выраженной остеокластической резорбции.
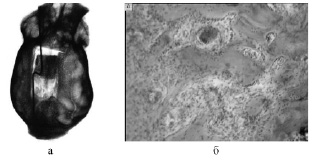
Рис. 1. 42-й день дистракции (группа 1): а) рентгенограмма костей свода черепа; б) формирование костных балочек в регенерате вблизи соединительнотканной прослойки. Окраска гематоксилином и эозином. Об. 6,3; ок. 10

Рис. 2. 90-е сутки после снятия аппарата (группа 1): а) рентгенограмма; б) гистотопограмма костей свода черепа. Окраска гематоксилином и эозином. Увеличение – лупное
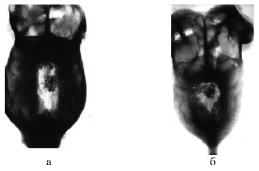
Рис. 3. Рентгенограммы костей свода черепа собак (группа 2): а) 30-е сутки фиксации, б) через 90 суток после снятия аппарата
В двух наблюдениях отмечены срастание трансплантата с краями дефекта на ранних стадиях эксперимента, отсутствие его смещения и прорезание спиц через трансплантат. В одном случае при повторной операции с целью мобилизации приросшего после некоторого перемещения трансплантата выявлено прочное спаяние его костной тканью с краями дефекта. Между трансплантатом и краем дефекта обнаружена костная ткань на протяжении 5 мм. Между ней и трансплантатом имелась прослойка шириной до 0,5 мм.
При замещении дефектов костей черепа с помощью ксенотрансплантатов на рентгенограммах костей свода черепа во всех наблюдениях к моменту окончания фиксации отмечено наличие костного регенерата, выраженного в разной степени (рис. 3а). Меньшим по площади был регенерат у собаки, где дефект был создан слева от сагиттальной линии, т.е. там, где толщина костей черепа была меньшей, чем в других экспериментах. Костный регенерат занимал здесь 1/2 часть диастаза между перемещенным трансплантатом и краем дефекта. Трансплантат подвергался резорбции.
Через 90 суток после снятия аппарата в диастазе был виден регенерат неоднородной плотности, заполнивший всю площадь диастаза (рис. 3б). Гомогенным регенератом заполнен был и весь диастаз у другой собаки. Дефект был полностью замещен. Гистологически в диастазе между каудальным концом трансплантата и задним краем дефекта определялись костный регенерат и зона соединительной ткани до 3 мм. Регенерат, отходящий от края материнской кости, состоял из губчатой кости грубоволокнистого строения. Часть трабекул его подвергалась резорбции, в костномозговых пространствах располагалась грануляционная ткань, инфильтрированная лейкоцитами. В одном наблюдении регенерат имел строение накладной кости, диплоэ содержало жировой костный мозг. Граница между трансплантатом и регенератом была неразличима, трансплантат подвергался интенсивной перестройке.
Регенерат сопоставимых величин
|
Длина регенерата и длительность фиксации у животных экспериментальных групп, M±SD |
||
|
Группа животных |
Длина регенерата, (мм) |
Длительность фиксации, сутки |
|
Аллотрансплантат |
19,6±0,6 |
31,1±2,0 |
|
Ксенотрансплантат |
20,3±0,5 |
35,1±4,6 |
На микропрепаратах костей свода черепа собак в медиальной части дефекта находили костный регенерат, отходящий от заднего края дефекта, протяженностью до 11 мм. Он состоял из пластинчатой кости с диплоэ, в центре которого сохранялся участок некротизированной компактной кости трансплантата. Латерально дефект был заполнен соединительной тканью, медиально соединительная ткань имелась только в передней части дефекта, на месте почти полностью рассосавшегося трансплантата.
В целом, по результатам исследования при использовании алло- и ксенотрансплантов в дефекте удалось сформировать регенерат сопоставимых величин (таблица), однако этап фиксации бел несколько выше при применении ксенотрансплантата (статистически значимых отличий не обнаружено). У животных обеих групп в ходе эксперимента не зафиксировано ни одного случая отторжения или инфицирования имплантата.
Результаты проведенного исследования показывают, что при дозированном перемещении подготовленных алло- или ксенотрансплантатов дефект костей свода черепа может замещаться костной тканью. Сформированный костный регенерат имел зональное строение, т.е. в нем определялись два костных отдела и соединительнотканная прослойка. Рост костной ткани происходил более активно со стороны края дефекта, от которого перемещается трансплантат. Образование костного регенерата от каудального конца последнего начиналось, в основном, в конце периода дистракции, когда в трансплантате активизировался остеогенез.
Применение данной технологии наряду с дальнейшей отработкой методики подготовки алло- или ксенотрансплантатов с целью повышения, например, их совместимости с тканями реципиента позволяет рекомендовать способ для внедрения в клиническую практику.
Заключение
Технология замещения дефектов костей свода черепа, включающая использование алло- и ксенотрансплантатов в качестве опоры для формирования в дефектах костей свода черепа дистракционного регенерата, может быть эффективна для целевого применения. Кроме того, данный подход – использование трансплантатов естественного и/или искусственного происхождения в качестве опорного элемента при дистракционном остеогенезе – может иметь перспективу применения и для замещения дефектов длинных костей.
Библиографическая ссылка
Дьячков А.Н., Солдатов Ю.П., Горбач Е.Н., Стогов М.В., Тушина Н.В. ТЕХНОЛОГИЯ ЗАМЕЩЕНИЯ ДЕФЕКТОВ КОСТЕЙ СВОДА ЧЕРЕПА С ИСПОЛЬЗОВАНИЕМ АЛЛО- И КСЕНОТРАНСПЛАНТАТОВ В КАЧЕСТВЕ ОПОРЫ ДЛЯ ФОРМИРОВАНИЯ РЕГЕНЕРАТА // Научное обозрение. Медицинские науки. 2023. № 6. С. 48-52;URL: https://science-medicine.ru/ru/article/view?id=1370 (дата обращения: 21.01.2026).
DOI: https://doi.org/10.17513/srms.1370
 science-review.ru
science-review.ru