Введение
Синдром полиорганной дисфункции возникает в результате дизрегуляции системной воспалительной реакции организма после перенесенного критического состояния и характеризуется повреждением тканей двух и более органов [1]. Согласно современной концепции, в основе системных органных нарушений при системном воспалительном ответе и сепсисе лежат нарушения структуры и функции различных клеток, в первую очередь эндотелиальных [2]. В связи с этим поиск биомаркеров, которые позволили бы в ранние сроки выявить эндотелиальную дисфункцию, представляет не только теоретический интерес, но и является одной из актуальных задач практической медицины критических состояний, в частности диагностики и лечения сепсиса [3, 4].
Согласно консенсусу «Сепсис-3», это заболевание определяют как опасную для жизни дисфункцию органов, вызванную нарушением регуляции реакции организма на инфекцию [5, 6]. Известно около 1000 биомаркеров сепсиса, но в связи с высокой гетерогенностью этого синдрома все они недостаточно чувствительные и специфичные. В настоящее время усилия исследователей направлены на поиск таких биомаркеров, которые бы отражали специфические биологические процессы, поддающиеся медикаментозной коррекции [7]. Показано, что процессы нарушения структуры и функции эндотелия связаны с повреждением гликокаликса, а оно может быть охарактеризовано изменениями уровня гиалуронана.
В качестве биомаркеров сепсиса используют определение СРБ (С-реактивный белок), прокальцитонина, пресепсина [7, 8]. Содержание прокальцитонина может повышаться не только при сепсисе, но и системном воспалительном ответе, обусловленным травмой [7]. Пресепсин более специфичен для грамотрицательного сепсиса. Липополисахарид клеточной стенки грамотрицательных бактерий взаимодействует с CD14 рецепторами макрофагов, гранулоцитов, моноцитов. CD14 является частью врожденной иммунной системы, выступающей в качестве рецептора для липополисахаридов (ЛПС) бактерий активирующих провоспалительный сигнальный каскад. Рецептор существует в двух формах: мембраносвязанный тип (mCD14) и растворимая форма (sCD14). Во время прогрессирования сепсиса происходит расщепление N-концевого фрагмента растворимой формы sCD14 эластазой, образуется белок молекулярной массой 13 кДа – пресепсин. Уровень пресепсина повышается в раннем периоде сепсиса [8]. Также к маркерам сепсиса относят и лактат, который постоянно образуется в эритроцитах, тканях разных органов и утилизируется печенью путем окисления или переводом в глюкозу. Нарушение детоксикационной функции печени при сепсисе приводит к повышению уровня лактата в крови [7]. Одним из маркеров полиорганной дисфункции при сепсисе может быть гиалуронан.
Цель исследования – анализ современных литературных данных о роли гиалуронана в механизмах развития эндотелиальной дисфункции и полиорганной недостаточности при системном воспалительном ответе и сепсисе
Материалы и методы исследования
Для решения поставленных задач были использованы 42 статьи баз данных PubMed, Scopus, MedLine, Web of Science, которые являются основными источниками информации. Для написания обзора применялся информационно-аналитический метод.
Результаты исследования и их обсуждение
Гиалуронан (син. гиалуроновая кислота, гиалуронат) – это углеводный биополимер, гликозоаминогликан, молекулярная масса которого варьирует от 0,4 до 8000 кДа [9]. Структура его представлена неразветветленной цепью дисахаридов: N-ацетил-D-глюкозамина и D-глюкуроновой кислоты, соединенных между собой чередующейся β-1,3, β-1,4 гликозидной связью (рис. 1) [10, 11].
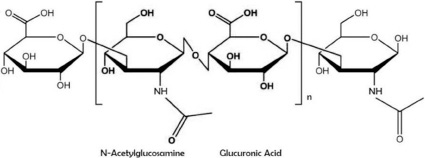
Рис. 1. Химическое строение гиалуронана [12]
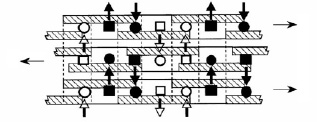
Рис. 2. Схематичное отображение межмолекулярных взаимодействий трех цепей гиалуронана [13] Заштрихованы гидрофобные участки молекул, вертикальные пунктирные линии обозначают углеводные единицы, ацетамидные (■ и □) и карбоксилатные группы (● и ○) расположены так, что между ними возможны водородные связи
С помощью ядерно-магнитного резонанса в молекуле гиалуронана выявлены внутримолекулярные связи, которые формируют витую спираль из линейного полимера. Обе стороны молекулы активны за счет радикалов СН2ОН и СООН с одной стороны и NHCOCH3 c другой. Структура молекулы позволяет устанавливать стабильные межмолекулярные взаимодействия с образованием сетчатой структуры с чередующимися гидрофильными и гидрофобными участками, что делает ее избирательно проницаемой для различных соединений (рис. 2) [13].
Биосинтез гиалуронана происходит на внутренней поверхности плазматической мембраны клетки с помощью ферментов гиалуронансинтаз (hyaluronan synthase HAS). HAS – это гликозилтрансферазы, представляющие собой интегральные мембранные белки [14]. В геноме человека выявлены гены, кодирующие три разных изофермента HAS 1, 2 и 3 [15]. HAS 2 является наиболее изученным ферментом, участвующим в синтезе гиалуронана [15, 16]. HAS распознает субстраты для синтеза – нуклеотидные дисахариды (уридиндифосфат-глюкуроновую кислоту и уридиндифосфат-N-ацетилглюкозамин) и катализирует образование β-1,3 и β-1,4 связей [14, 17, 18]. Связанные с HAS липиды мембраны клетки участвуют в формировании пор для прямой транслокации синтезирующегося гиалуронана. Высказывается мнение, что HAS может быть также связан с механизмом транспорта полисахаридов на мембране клетки [14]. Синтезированный гиалуронан выводится через плазматическую мембрану во внеклеточное пространство, таким образом, обеспечивая неограниченный рост полимера, и взаимодействует с рецептором CD44 [14, 19, 20]. CD44 принадлежит к семейству гиалуронансвязывающих белков и располагается трансмембранно [21]. CD44 имеет множество изоформ, но в целом структура его состоит из экстрацеллюлярной, трансмембранной и цитоплазматической частей. Внеклеточная часть содержит концевой домен с аминогруппой, который связывается с гиалуронаном [22]. Разрушение гиалуронана происходит под действием ферментов гиалуронидаз (hyaluronidase HYAL1 и 2). Сначала расщепление молекулы гиалуронана идет на уровне плазматической мембраны с помощью HYAL2 при взаимодействии с рецепторами CD44, затем фрагменты гиалуроновой кислоты интернализуются, доставляются в эндосомы и лизосомы, далее фрагменты гиалуронана разрушаются HYAL1, лизосомальными ферментами [15, 19].
Гиалуронан входит в состав гликокаликса, который образует гелеобразный слой на поверхности эндотелиальных клеток кровеносных сосудов. Основу гликокаликса составляют синдекан-1-4 (более 50 %), хондроитинсульфат, гепарансульфат, гиалуронан [20, 23]. Гиалуронан, являясь линейным полимером, фиксируется на эндотелии сосудов при образовании связи с трансмембранными рецепторами эндотелиальных клеток CD44 [20].
Гликокаликс выполняет несколько функций: служит барьером между эндотелием сосудов и кровью, обладает избирательной проницаемостью, создавая градиент осмотического давления между стенкой сосуда и кровотоком. Гликокаликс является резервуаром для таких ферментативных систем, как липопротеинлипаза, внеклеточная супероксиддисмутаза, антитромбин III, антикоагулянты гепарансульфаты и тромбомодулин [23]. Эти ферменты участвуют в гомеостазе липидов, антикоагулянтных реакциях, определяют способность сосудистой стенки реагировать на повреждающие воздействия [23, 24]. При нарушении гомеоcтаза крови происходит разрушение гликокаликса, что приводит к дисбалансу ферментативных систем, нарушению выделения NO, расширению сосудов и повышению их проницаемости [23].
При сепсисе происходит деградация гликокаликса, так как при воздействии активных форм кислорода, провоспалительных цитокинов (TNF-α, IL-1β) происходит активация ферментов гепараназы, гиалуронидазы, металлопротеиназы, что приводит к разрушению гликокаликса эндотелиальных клеток сосудов [24]. Эндотоксемия при сепсисе вызывает эндотелиальную дисфункцию. В клетках эндотелия сосудов нарушается механотрансдукция, снижается выработка НАДН-зависимого белка сиртуина-1, который регулирует клеточные процессы и метаболические пути. Повышается образование активных форм кислорода, активируются металлопротеиназы, гиалуронидаза. Металлопротеиназы (ММП-2 и ММП-9) в активной и проактивной формах хранятся в везикулах эндотелиальных клеток и могут высвобождаться этими клетками при сепсисе, разрушая гликокаликс сосудов. Гиалуронидаза расщепляет гиалуронан на апикальной поверхности эндотелиальных клеток. При сепсисе снижение сиртуина-1 приводит к переходу NF-κB из неактивной формы в активную, происходит транслокация последней в ядро клетки и активация синтеза гепараназы. Гепараназа синтезируется в виде препрогепараназы, прогепараназы в эндоплазматическом ретикуллуме, транспортируется в аппарат Гольджи, где упаковывается в везикулы и затем секретируется [25, 26]. В результате эндотелиальной дисфункции, активации ферментов эндотелиальных клеток сосудов повышается адгезия и миграция нейтрофилов из кровеносного русла, увеличивается проницаемость эндотелия для белков и жидкости, нарушается передача сигналов NO [27, 28]. В итоге это приводит к полиорганной недостаточности, характеризующейся острым респираторным дистресс-синдромом [27], печеночной и почечной недостаточностью. Компоненты гликокаликса, в частности фрагменты молекулы гиалуронана, попадающие в кровоток, могут служить биомаркерами эндотелиальной дисфункции при сепсисе, так как по уровню гиалуронана можно прогнозировать развитие полиорганной недостаточности [24, 26, 27].
Воздействие гиалуронидаз на гиалуронан было исследовано с помощью ядерно-магнитного резонанса 13С. Scott J.E с соавт. в эксперименте рассмотрели спектр 13С гиалуронана (=106) и сравнивали со спектром образца, подвергшегося воздействию гиалуронидазы [13]. Спектры 13С были сопоставимы, что говорит об отсутствии изменений в базовой химической структуре молекулы. Под воздействием гиалуронидаз уменьшается молекулярная масса гиалуронана и образуется тетрасахарид [13].
В клинических и экспериментальных исследованиях измерение содержания гиалуронана в сыворотке крови проводится с помощью метода подобного ИФА. Это связано со структурной гомогенностью гиалуронана, наблюдающейся у разных позвоночных, поэтому антитела к нему получить сложно, так как они не являются специфичными [29, 30]. Для определения гиалуронана используются биотинилированные гиалуронан-связывающие белки (bHABP – HA-specific binding protein) – агрекан, версикан, нейрокан и бревикан, которые обладают высокой специфичностью [30]. Диапазон концентрации, который можно измерить данным методом, составляет 10–2500 нг/мл [31].
Анализ уровня гиалуронана возможен с помощью гельфильтрационной хроматографии (Sephacryl S-1000). Можно выделить гиалуронан из плазмы крови в виде фракций, содержащих фрагменты молекул с разной массой, а затем измерить его количество с помощью ELISA-набора [32].
Молекулярную массу гиалуронана можно определять также методом электрофореза в агарозном или полиакриламидном геле [33]. Гиалуронан имеет постоянное соотношение заряда к массе, независимо от длины молекулы. При проведении электрофореза под действием электрического поля при прохождении молекул через матрицу геля происходит разделение гиалуронана по размеру молекул. Для детектирования используется катионный краситель: Stains-All (3,3’-диметил-9-метил-4,5,4’,5’-дибензотиакарбоцианин). Сканирование окрашенных гелей позволяет получить количественные данные о распределении гиалуронана с разной молекулярной массой [33].
Анализ динамики изменения гиалуронана возможен не только при определении циркулирующих в крови молекул разной молекулярной массы, но и при оценке его продукции по экспрессии гена HAS 2 [15]. Уровни экспрессии изоформ HAS 1, 2, 3 различаются в тканях, что говорит о существовании множества местных регуляторных молекул, которые по-разному влияют на мРНК HAS и стабильность белка [34]. Так, HAS 1 и 3 экспрессируются в сердце, печени, скелетных мышцах, предстательной железе и яичниках. HAS 2 преобладает в сердце и подслизистой основе тонкой кишки [35].
Основная проблема определения гиалуронана в моче связана с его низкой концентрацией, поэтому используется высокоэффективная жидкостная хроматография в сочетании с масс-спектрометрией. При разрушении гликокаликса клубочков почек в моче повышается уровень не только гиалуронана, но и гепарансульфата, концентрация последнего достаточно высокая, порядка мкг/мл. Поэтому при сепсисе более доступным является измерение в моче гепарансульфата. Его можно определять при помощи колориметрического метода с использованием диметилметиленового синего и ИФА-ридера [36].
Возможности широкого диагностического использования определения гиалуронана в сыворотке крови и моче у больных сепсисом ограничиваются тем, что методики его выявления трудоемки и не стандартизированы. В экспериментальных исследованиях при сепсисе гиалуронан рассматривается и как прогностический маркер, и как терапевтическое средство. Гиалуронан гидрофилен, обладает выраженными коллоидно-осмотическими свойствами. Поэтому некоторые исследователи предпринимают попытки использования этого соединения для коррекции гемодинамических нарушений при сепсисе. Так, в эксперименте свиньям с перитонитом, моделированным путем введения в брюшную полость кала 2 г/кг массы тела, с терапевтической целью внутривенно вводили растворы гиалуронана с молекулярной массой 1560 кДа. В сыворотке крови у животных с сепсисом через 18 ч после развития гемодинамических нарушений, достоверно в 3 раза повышался уровень гиалуронана в крови, причем как высоко-, так и низкомолекулярных его соединений. В группе с внутривенным введением растворов гиалуронана его уровень измеряли в сыворотке крови через 6, 12, 18 ч от начала гемодинамических нарушений, и уровень гиалуронана был выше, чем в группе животных с сепсисом, за счет экзогенного введения препарата [32].
В эксперименте изменения уровня гиалуронана при сепсисе изучены на крысах. При моделировании сепсиса с помощью внутриартериального введения ЛПС (липополисахарида) в группе животных с искусственной вентиляцией легких было выявлено острое повреждение легких в течение 4 ч после введения. Для исследования влияния гиалуронана в модели сепсиса животным вводили внутрибрюшинно высокомолекулярный гиалуронан 1600 кДа в концентрации 0,35 % за 18 ч до введения ЛПС и внутривенно через 1 ч после инъекции ЛПС в различных концентрациях (0,025; 0,05 или 0,1 %). По результатам исследования в эксперименте показано, что гиалуронан, при профилактическом введении снижал воспалительную инфильтрацию легких нейтрофилами, уменьшал экспрессию мРНК и содержание макрофагального воспалительного белка-2 (Macrophage inflammatory protein-2 (MIP-2)) и TNFα. При внутривенном введении гиалуронана через 1 ч после ЛПС отмечалось дозозависимое уменьшение повреждений легких [37]. Таким образом, при сепсисе гиалуронан может рассматриваться не только как маркер повреждения гликокаликса, но и как средство для коррекции органной недостаточности.
В клинических исследованиях с помощью масс-спектрометрии определяли уровни гиалуронана при септическом шоке и ОРДС. Появление гиалуронана в моче в первые 24 ч от постановки диагноза септический шок коррелирует с развитием острой почечной недостаточности в последующие 72 ч. Повышение гиалуронана в моче является предиктором летальности у пациентов с сепсисом [36].
В норме концентрация гиалуронана в сыворотке крови человека составляет 20–40 нг/мл. При сепсисе уровень гиалуронана повышается. При развитии септического шока его уровень был выше, чем при сепсисе. По данным ROC-анализа пороговое значение гиалуронана для прогнозирования смертности составило 441 нг/мл, а синдекана, который также входит в состав гликокаликса – 898 нг/мл. Специфичность и отрицательная прогностическая значимость этих показателей была высокой и составила 90 % и 90 % соответственно, на 7-е сутки для гиалуронана; 86 % и 91 % на 5-е, 7-е сутки для синдекана [38].
По результатам ряда исследований уровень экспрессии HAS 2 в проксимальных канальцах почек человека возрастал при их повреждении и заболеваниях, связанных с интерстициальным фиброзом и атрофией почечных канальцев, диабетической нефропатией [39]. В эксперименте при моделировании сепсиса введением ЛПС установлена связь повреждения легких с повышенной экспрессией мРНК HAS 3 и продукцией гиалуронана низкой молекулярной массы. Снижение экспрессии HAS 3 с помощью блокатора фосфодиэстеразы 3 (милринон) приводило к уменьшению воспалительных изменений в легких при моделировании сепсиса [40].
При оценке уровня гиалуронана при сепсисе необходимо учитывать, что разрушенный гиалуронан метаболизируется локально, а также продукты его распада выводятся через эндотелиальные клетки синусоидных капилляров печени [20, 41]. Уровень гиалуронана в крови является результатом баланса между образованием его фрагментов и их выведением [20]. Таким образом, повышение в крови гиалуронана может предшествовать развитию печеночной недостаточности при сепсисе [20, 32]. Появление гиалуронана в моче связано прежде всего с разрушением гликокаликса эндотелиальных клеток сосудов клубочков почек, что позволяет прогнозировать развитие почечной недостаточности [23, 36]. В норме гликокаликс эндотелиальных клеток капилляров ограничивает прохождение макромолекул, таких как альбумин, при фильтрации больших объемов плазмы, тем самым сохраняя гомеостаз крови [42].
Заключение
Биология критических состояний является новым и перспективным направлением практической медицины. Поэтому исследование молекулярных механизмов тканевых повреждений при системном воспалительном ответе и сепсисе является необходимым для их диагностики и коррекции. Дальнейшая разработка методов коррекции эндотелиальной дисфункции на основе оценки содержания гиалуронана может быть перспективным направлением в лечении таких синдромов, как сепсис, острый респираторный дистресс-синдром, острая почечная и печеночная дисфункции.
Библиографическая ссылка
Пономаренко Е.А., Диатроптова М.А., Мхитаров В.А., Хомякова Т.И., Бабаев М.А., Артемьева К.А., Макарова О.В. ГИАЛУРОНАН КАК БИОМАРКЕР ПОЛИОРГАННОЙ НЕДОСТАТОЧНОСТИ ПРИ СЕПСИСЕ // Научное обозрение. Медицинские науки. 2024. № 4. С. 49-55;URL: https://science-medicine.ru/ru/article/view?id=1415 (дата обращения: 24.12.2025).
DOI: https://doi.org/10.17513/srms.1415
 science-review.ru
science-review.ru