Введение
Наиболее часто встречаемой патологией перинатального периода является респираторный дистресс-синдром новорожденных (РДСН), развивающийся вследствие дефицита сурфактанта. Респираторный дистресс-синдром новорожденных характеризуется отрицательными маркерами воспаления и отрицательным результатом микробиологического исследования крови [1, с. 176]. Однако их рекомендуют проводить в динамике, через 48 ч, если в первые сутки жизни ребенка диагноз РДСН выставить затруднительно [2]. Из множества провоспалительных и противовоспалительных цитокинов основными маркерами воспалительного процесса в тканях и органах человека считают интерлейкин-1 (ИЛ-1), интерлейкин-6 (ИЛ-6), интерлейкин-10 (ИЛ-10). Исследование провоспалительных маркеров (С-реактивный белок (СРБ), прокальцитонин (ПКТ), ИЛ-6) продемонстрировало значимость данных биомаркеров при прогнозировании и раннем выявлении инфекционно-воспалительных заболеваний у крайне незрелых недоношенных пациентов [3]. Результаты исследования российских ученых показали также неравноценность гематологических индексов для диагностики респираторного дистресс-синдрома и внутриутробной пневмонии у недоношенных новорожденных. Лейкоцитарный индекс является более чувствительным к неучтенным внешним факторам, способным влиять на его значение, в том числе на гипоксию [4].
Дети, рожденные недоношенными, чаще и тяжелее страдают от инфекций дыхательных путей и хрипов по сравнению с доношенными детьми. Снижение риска этих заболеваний в этой группе имеет критическое значение для улучшения качества жизни, уменьшения потребности в медикаментозном лечении в младенчестве, а также для снижения вероятности развития астмы и хронической обструктивной болезни легких в более старшем возрасте. До сих пор умеренно поздно недоношенные дети недостаточно исследованы, и механизмы их заболеваемости остаются в значительной степени неизведанными, несмотря на то, что они составляют 80 % всех недоношенных детей. Для эффективной защиты этих детей необходимо понимать роль иммунной системы в здоровье дыхательных путей на ранних этапах жизни и разрабатывать стратегии для оптимизации иммунной системы и поддержания здоровья дыхательных путей [5].
Учитывая актуальность проблемы респираторного дистресс-синдрома и важность дифференциальной диагностики, целью исследования является изучение роли медиаторов воспаления и иммунного статуса в развитии РДСН.
Материалы и методы исследования
Исследование проведено в отделениях реанимации и патологии новорожденных детей (ОПН) Городского перинатального центра (ГПЦ) г. Бишкека КР. Иммунный статус изучен у 80 недоношенных детей с РДСН. Период наблюдения – с момента рождения до выписки.
При иммунологических исследованиях использовались тест-наборы: «Интерлейкин-6-ИФА-БЕСТ», «Интерлейкин-10-ИФА-БЕСТ», «альфа-ФНО-ИФА-БЕСТ», «IgG общий-ИФА-БЕСТ», «IgМ общий-ИФА-БЕСТ», «IgЕ общий-ИФА-БЕСТ», «IgА общий-ИФА-БЕСТ» ИФА проводился на оборудовании МR-96А Mindray. Нормативные показатели цитокинов взяты из инструкции по применению данных реагентов [6, с. 3; 7, с. 9; 8, с. 4]. В лаборатории на базе ГПЦ проводились общий и биохимический анализы крови с использованием анализатора «Mindray BC-2300», газовый анализатор STAT Prime LNF 088028. Статистическая обработка материала проводилась программой «Microsoft Excel». Различия показателей считались статистически значимыми при уровне значимости p < 0,05.
Результаты исследования и их обсуждение
При рождении все показатели периферической крови находятся в пределах нижних возрастных нормативов с дальнейшей тенденцией к снижению к концу пребывания в ОПН. Однако даже к 10-му дню жизни физиологического нейтрофильно-лимфоцитарного перекреста не наблюдается (рис. 1).
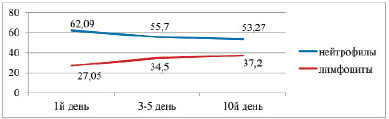
Рис. 1. Нейтрофильно-лимфоцитарное соотношение у недоношенных с РДСН в %
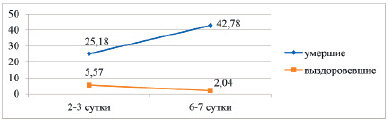
Рис. 2. Динамика СРБ у умерших и выздоровевших больных в %
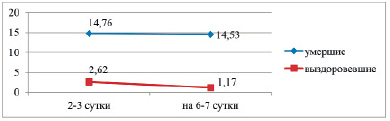
Рис. 3. Динамика ПКТ у умерших и выздоровевших больных в %
С-реактивный белок (СРБ) в первые 2–3 дня жизни у недоношенных с РДС находится на уровне возрастных нормативов. Однако ближе к исходу в ОПН повышается более чем в 7 раз (р < 0,001). В то же время уровень прокальцитонина уже в первые дни жизни повышен более чем в 2 раза от возрастных нормативов (р < 0,01). И так же более чем в 7 раз (р < 0,001) повышается к концу пребывания в ОПН. Более чувствительным оказался медиатор воспаления – прокальцитонин (ПКТ), так как он уже повышен в первые дни жизни. Следует отметить, что ПКТ является более чувствительным медиатором воспаления, чем СРБ. Установлены значительные различия в динамике медиаторов воспаления у выздоровевших и умерших детей с РДС. Так, уровень СРБ в первые дни жизни у умерших детей уже выше в 4,5 раза (р < 0,001), чем у выздоровевших. На 6–7-е сутки СРБ у умерших статистически значимо (р < 0,05) повышается, в то время как у выздоровевших больных с более высокой степенью статистической значимости (р < 0,01) снижается (рис. 2).
У умерших больных уровень ПКТ так же более чем в 7 раз повышен уже в первые дни жизни и остается на тех же более высоких показателях к исходу (р > 0,05). У выздоровевших детей уровень ПКТ в пределах нормы в первые дни жизни и статистически значимо (р < 0,01) снижается к выздоровлению (рис. 3).
Кислотно-основное состояние крови определено у 44 недоношенных детей с РДС. При сравнении показателей внутри группы, у 42 детей (95,45 %) выявлен ацидоз, с преобладанием метаболического ацидоза над респираторным ацидозом (59,09 % над 36,36 %, р < 0,05) (табл. 1).
Таблица 1
Кислотно-основное состояние крови у недоношенных с РДС
|
Кислотно-основное состояние крови |
Недоношенные дети РДС (n = 44) |
|
Метаболический ацидоз |
26 (59,09 %)* |
|
Респираторный ацидоз |
16 (36,36 %) |
|
Алкалоз |
2 (4,54 %) |
|
Всего |
44 (100 %) |
Примечание: * – р < 0,05.
Иммунологический статус изучен у 80 недоношенных с РДС. По сравнению с нормативными показателями выявлено увеличение провоспалительного цитокина ИЛ-6 (р < 0,001) и несколько повышенный уровень (р > 0,05) провоспалительного цитокина ФНО. В то же время ответная реакция организма с выработкой противовоспалительного цитокина ИЛ-10, подавляющего функцию провоспалительных цитокинов резко снижена по сравнению с нормой (8,04±0,65 против 0–31 пг/мл, р < 0,001). В итоге формируется дисфункция клеточного звена иммунитета с преобладанием провоспалительных цитокинов, лежащих в основе риска развития у детей с РДС каскадной системной воспалительной реакции вплоть до инфекционно-токсического шока, сепсиса, полиорганных дисфункций и летального исхода (табл. 2).
В целом отмечается и гипофункция гуморального звена иммунитета с отсутствием выработки у недоношенных детей с РДС Ig A, IgM и Ig Е. В то же время нормальный уровень IgG можно трактовать как материнский, так как он легко проникает через маточно-плацентарный барьер (табл. 3).
Таким образом, при изучении иммунологического статуса недоношенных детей с РДС установлена дисфункция клеточного звена иммунитета с преобладанием провоспалительных цитокинов и гипофункция гуморального звена иммунитета, что повышает риск развития системной воспалительной реакции.
Также можно констатировать, что показатели периферической крови при рождении и в динамике находятся в пределах нижних возрастных нормативов. Отсутствие нейтрофильно-лимфоцитарного перекреста весь период пребывания недоношенных детей в отделении патологии новорожденных можно расценить как реакцию крови на контаминационную инфекцию в анте-, интра- и постнатальном периодах. Тем более что всем детям с РДС потребовалась первичная реанимационная помощь с применением СРАР и ИВЛ. К аналогичному выводу пришли и О.Н. Альмухаметова с соавт. [9].
Российскими авторами установлено: у новорожденных с РДС и ГИЭ в общем анализе крови относительное количество лимфоцитов у недоношенных новорожденных превышало аналогичные показатели детей контрольной группы, при этом регистрировалось сниженное содержание сегменто-ядерных нейтрофилов и моноцитов. Относительный лимфоцитоз, регистрируемый у детей обеих групп, можно расценивать как активацию клеточного иммунитета и противодействие реализации внутриутробной инфекции. Аналогичные результаты, свидетельствующие об относительном лейкоцитозе, были получены ранее у детей с экстремально низкой массой тела и тяжелым гипоксически-ишемическим поражением [10]. Однако при анализе показателей крови у детей с пневмониями и РДС Л.Н. Журавлева и соавт. не получили значимой разницы между сравниваемыми группами детьми, в группе детей с неонатальными пневмониями в показателях крови не было обнаружено статистически значимого лейкоцитоза, сдвига лейкоцитарной формулы влево и также повышения СРБ [11].
Таблица 2
Показатели воспалительных и противовоспалительных цитокинов
|
Группа |
Недоношенные с РДС (n = 80) |
Нормативные показатели по инструкции |
|
Провоспалительные цитокины |
||
|
ИЛ-6 |
52,72±7,98*** |
0–10 пг/мл |
|
ФНО |
7,4±0,60 |
0–6 пг/мл |
|
Противовоспалительные цитокины |
||
|
ИЛ-10 |
8,04±0,65 |
0–31 пг/мл |
Примечание: * – р < 0,05; ** – р < 0,01; *** – р < 0,001.
Таблица 3
Показатели гуморального звена иммунитета
|
Группа |
Недоношенные с РДС (n = 80) |
Нормативные показатели по инструкции |
|
Ig A |
0 |
0,7–4,0 г/л |
|
IgM |
0,62±0,31 |
0,4–2,4 г/л |
|
IgG |
17,95±0,65 |
7–16 г/л |
|
Ig Е |
0 |
15 МЕ/мл |
Повышение уровня медиаторов в организме новорожденных свидетельствует о развитии инфекционного процесса еще в антенатальном и интранатальном периодах при наличии заболеваний матерей. В научных исследованиях как значимые факторы развития РДС у недоношенных отмечаются вирусная и бактериальная этиология, во время беременности отмечены генитальные воспалительные заболевания матерей, патология и преждевременное отхождение околоплодных вод в родах [12]. Анализ исходных показателей и динамики уровней медиаторов воспаления позволяет утверждать, что уже по их исходным показателям возможно прогнозировать тяжесть течения заболевания. Рост уровня СРБ и ПКТ в динамике развития заболевания является прогностически неблагоприятным показателем, свидетельствующим о росте тяжести заболевания и риске неблагоприятного исхода. Снижение же в динамике уровня медиаторов является прогностически благоприятным показателем.
Как известно, метаболический ацидоз вызван нарушением обмена веществ с повышенной секрецией кислот. В то же время респираторный ацидоз вызван недостаточной вентиляцией легких и наблюдается при тяжелых и крайне тяжелых состояниях. Следовательно, наличие и метаболического, и респираторного ацидоза у недоношенных больных свидетельствует, что в генезе дыхательной недостаточности у недоношенных с СДР лежат как метаболические, так и респираторные нарушения обмена веществ. Однако преобладание метаболического ацидоза свидетельствует о более длительной гипоксии в организме детей, требующей срочного лечения. Полученные данные по кислотно-основному состоянию крови подтверждаются данными российских ученых. Так, метаболический ацидоз, характеризующийся дефицитом оснований, в обеих группах наблюдался в 40,4 и 52,9 % случаев. Респираторный ацидоз отмечен у 14,8 % среди детей, умерших в раннем неонатальном периоде, в то время как среди детей, умерших в позднем неонатальном периоде, данное состояние не отмечено. Смешанный ацидоз выявлен в 25,5 и 29,4 % случаев [13]. По данным российских коллег, при РДС статистически значимый уровень спонтанной хемилюминесценции нейтрофилов и моноцитов, что отражает высокий уровень продукции фагоцитами активных форм кислорода в условиях повышенной антигенной стимуляции. Сывороточный уровень провоспалительных цитокинов (ИЛ-1, ФНО-a ) у детей с РДС на 5–7-е сутки жизни статистически значимо ниже, чем у здоровых новорожденных. При этом сывороточные концентрации ИЛ-4 и ТФР-b 1 достоверно не различаются [3]. Однако по результатам данного исследования можно сказать, что показатели провоспалительных цитокинов с высокой статистической значимостью превышают нормативные показатели. Это может указывать на наличие воспалительного процесса или особую реакцию иммунной системы у недоношенного, что требует большего изучения в данной области.
Заключение
Для РДС недоношенных детей характерны гиперпродукция провоспалительных цитокинов на фоне снижения активности противовоспалительных цитокинов и дисфункции гуморального звена иммунитета с отсутствием выработки Ig A и Ig Е и низкими уровнями IgM и IgG, повышающие риск развития системной воспалительной реакции. В генезе дыхательной недостаточности у недоношенных с РДС лежат метаболические и респираторные нарушения обмена веществ, требующие безотлагательной коррекции. Целесообразно контролировать развитие респираторных нарушений и воспалительных процессов в легких при респираторном дистресс-синдроме путем определения динамического количества провоспалительных интерлейкинов (IL-6, SNF-α) и противовоспалительного ИЛ-10 у новорожденных, по динамике показателей медиаторов воспаления и иммунологического статуса возможно прогнозировать течение, тяжесть и исход заболевания.
Библиографическая ссылка
Боконбаева С.Дж., Урматова Б.К., Зейвальд С.В., Асанбекова Ж.А. ИММУННЫЙ СТАТУС И МЕДИАТОРЫ ВОСПАЛЕНИЯ У НЕДОНОШЕННЫХ НОВОРОЖДЕННЫХ С РЕСПИРАТОРНЫМ ДИСТРЕСС-СИНДРОМОМ // Научное обозрение. Медицинские науки. 2025. № 2. С. 16-21;URL: https://science-medicine.ru/ru/article/view?id=1436 (дата обращения: 24.12.2025).
DOI: https://doi.org/10.17513/srms.1436
 science-review.ru
science-review.ru