Введение
Тиоацетамид (далее – ТАА) – химическое вещество, получаемое из ацетата аммония и сульфида алюминия [1, 2]. Токсичные свойства ТАА хорошо известны: его воздействие на организм может вызывать повреждение печени, почек и других органов [3, 4]. ТАА является модельным токсикантом для воспроизведения в эксперименте острых и хронических поражений печени [5]. Вместе с тем, учитывая тесную почечно-печеночную функциональную взаимосвязь в организме, актуальным представляется вопрос изучения влияния ТАА-воздействия и на почки. При многих отравлениях выявляются функциональные и деструктивные изменения в почках, обозначаемые как токсическая нефропатия [6]. Имеются данные, что и при воздействии ТАА происходят патологические изменения в почках, вплоть до интерстициального фиброза [7]. Отмечено, что ключевыми моментами повреждения почек ТАА являются развитие воспалительной инфильтрации, застой крови в гломерулах и гибель клеток проксимальных почечных канальцев, что приводит к утрате их функциональной способности [8]. По результатам исследований, проведенных в последние годы, предлагается несколько вариантов защиты почек при ТАА-индуцированном воздействии. Так, было отмечено, что антиоксиданты (таурин) уменьшали признаки воспаления, вызванные ТАА [9]. Использование эритропоэтина показало снижение процессов клеточного апоптоза в почках [10]. Коррекция силимарином и ресвератролом также приводила к снижению клеточной гибели [11, 12].
Важную роль в поддержании стабильности генома в клетке, при невозможности удаления повреждения, играет молекулярная система, вызывающая остановку клеточного цикла. Активируясь в ответ на нарушения структуры ДНК, специфические протеинкиназы фосфорилируют эффекторные киназы Chek1, которые играют роль своеобразного «переключателя» между апоптозом и репарацией. В результате замедляется репликация ДНК и предотвращается вход клеток в митоз [13].
Цель исследования – изучить экспрессию гена Chek1 и патоморфологические изменения в почках экспериментальных животных при длительном воздействии тиоацетамида и на фоне медикаментозной коррекции.
Материалы и методы исследования
Экспериментальные исследования длительностью 100 дней проведены на 56 аутбредных конвенциональных крысах-самцах с начальным весом 170–190 г, возрастом 10–12 недель на начало работы. Во время проведения эксперимента крыс содержали в стандартных условиях вивария при 12-часовом световом режиме и температуре 21–26°С. Животные были поровну распределены в 4 группы, по 14 животных в каждой:
I группа – отрицательный контроль (введение эквивалентного объема физ. раствора);
II группа – положительный контроль (введение ТАА в разовой дозе 50 мг/кг массы тела [5] внутрибрюшинно 2 раза в неделю);
III группа – ТАА в той же дозе + адеметионин в разовой дозе 25 мг/кг массы тела за 1 ч до ТАА;
IV группа – ТАА в той же дозе + препарат МГ-10 (комплексное соединение 5-гидрокси-6-метилурацила с ацетилцистеином) в разовой дозе 500 мг/кг массы тела [14] за 1 ч до ТАА.
В качестве контрольного вещества и носителя использовали физиологический раствор.
Для оценки кратности экспрессии гена Chek1 (Checkpoint kinase 1; идентификатор гена согласно NCBI – 140583; референсная мРНК последовательность согласно GenBank – NM_080400.2) кусочки почек сразу после декапитации и вскрытия крыс замораживали в жидком азоте и заливали реагентом Extract RNA («Евроген», Россия) для дальнейшего выделения РНК. Синтез кДНК проводили с матрицы выделенной тотальной РНК с использованием набора реактивов MMLV RT kit и праймеров олиго(dT)15 («Евроген», Россия). Изучение экспрессии генов в норме и при интоксикации ТАА проводили с использованием олигонуклеотидных специфичных праймеров и интеркалирующего красителя SYBR Green методом ПЦР в режиме реального времени на амплификаторе Rotor-Gene Q («Qiagen», Германия). Уровень экспрессии мРНК стандартизировали относительно экспрессии гена GAPDH – ген белка «домашнего хозяйства». В настоящем исследовании мы сконцентрировались на Chek1, поскольку именно эта киназа, активируемая в ответ на повреждения ДНК, осуществляет критическую регуляцию перехода между остановкой клеточного цикла и запуском репарационных процессов, напрямую влияя на судьбу клетки (репарация или апоптоз) [13].
Кусочки почек для гистологического исследования были фиксированы в 10 % нейтрально забуференном формалине, затем подвергали их стандартной гистологической проводке. Из залитой парафином ткани на ротационном микротоме «Leica RM 2125 RTS» («Leica Biosystems», Германия) готовили срезы толщиной 5–7 мкм. Препараты окрашивали гематоксилин-эозином и помещали в среду для заключения препаратов Limonen mounting medium, затем визуализировали с помощью имиджинговой системы Celena X («Logos Biosystems», Южная Корея) с увеличением х200.
Для изучения показателей в эксперименте использовали две временные точки: 50 и 100 дней от начала эксперимента, подвергая эвтаназии (с помощью углекислого газа с последующей декапитацией) по половине животных (7) из каждой группы. Условия проведения и вывода животных из эксперимента осуществляли с соблюдением международных принципов Хельсинской декларации о гуманном отношении к животным.
Статистический анализ проводили с помощью программного обеспечения SPSS Statistics 21.0 (IBM, USA). В качестве критерия нормальности распределения признаков в изучаемых группах использовали критерий Колмогорова – Смирнова. При нормальном распределении данных для оценки значимости различий между группами использовали однофакторный дисперсионный анализ (ANOVA) и апостериорные критерии Тьюки и Тамхейна. Данные представлены как среднее арифметическое и стандартная ошибка. Для обеспечения надежности и воспроизводимости полученных результатов использовали также метод бутстрап (Bootstrap), основанный на многократной генерации выборок методом Монте-Карло. Различия считали статистически значимыми при р < 0,05.
Результаты исследования и их обсуждение
В результате анализа статистических данных, полученных в ходе эксперимента, рассчитаны пределы колебаний экспрессии гена Chek1 в тканях почек у различных экспериментальных групп крыс (рис. 1). Исследование определило, что минимальное значение данного показателя было зафиксировано в группе отрицательного контроля (К-), составляя -9,92±0,18.
В контрольной группе, подвергшейся воздействию ТАА (К+), среднее значение экспрессии данного гена в почках составило -9,77±0,21, что было незначимо выше, чем в группе К- (p = 1,0). В группе, получавшей сочетание ТАА с адеметионином, показатель экспрессии гена Chek1 составлял -9,37±0,23. Это также незначимо превышало данные группы К- (p = 0,382). В группе крыс, которым вводили ТАА и препарат МГ-10, значение экспрессии определялось на уровне -9,88±0,31, что было ближе к значению показателя в группе К- (p = 0,924).
Результаты исследования экспрессии гена Chek1 в почках через 100 дней показывают, что наименьший средний уровень его кратности был зафиксирован в контрольной отрицательной группе (К-) и составил -10,30±0,21 (рис. 2). Максимальные значения наблюдались в группе ТАА + МГ-10 и составили -8,70±0,69. Экспрессия гена Chek1 в группе ТАА (К+) составила -9,44±0,32, что статистически незначимо отличалось от контрольной отрицательной группы (p = 0,146). Аналогичное отсутствие значимой разницы выявлено и при сравнении группы ТАА + адеметионин (-9,40±0,49) с контрольной отрицательной группой (p = 0,378), а также в группе ТАА + МГ-10 по сравнению с контрольной отрицательной группой (p = 0,129).
При сравнении групп ТАА + адеметионин и ТАА (К+) значимое различие не наблюдалось (p = 0,942). Сравнение группы ТАА + МГ-10 с группой ТАА (К+) также не выявило значимых различий в экспрессии гена Chek1 (p = 0,98). Наконец, между группами ТАА + МГ-10 и ТАА + адеметионин также не было обнаружено статистически значимых различий (p = 0,826).
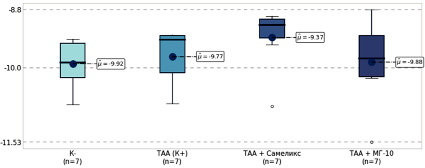
Рис. 1. Уровень экспрессии гена Chek1 в почках крыс через 50 дней эксперимента
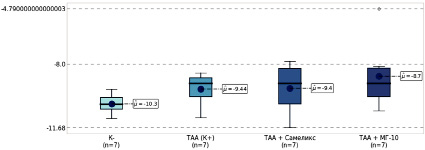
Рис. 2. Уровень экспрессии гена Chek1 в почках крыс через 100 дней эксперимента
Проведенное исследование экспрессии гена Chek1, играющего ключевую роль в регуляции клеточного цикла и репарации ДНК, в почечной ткани крыс выявило ряд важных закономерностей. На протяжении 100-дневного эксперимента наблюдалась определенная динамика изменения уровня экспрессии данного гена под воздействием токсического агента ТАА и исследуемых препаратов (адеметионин и МГ-10), однако статистически значимых межгрупповых различий зафиксировано не было.
В первые 50 дней эксперимента минимальные значения экспрессии отмечались в группе отрицательного контроля (К-), что отражало физиологический базовый уровень активности гена. Незначительное повышение показателей в группе ТАА (К+) могло свидетельствовать о начальной реакции клеток на токсическое воздействие, однако отсутствие статистической значимости (p = 1,0) указывает либо на слабый повреждающий эффект используемой дозы ТАА, либо на эффективную работу компенсаторных механизмов. Примечательно, что в группе, получавшей комбинацию ТАА с адеметионином, наблюдалась тенденция к более выраженному росту экспрессии, что потенциально могло отражать модулирующее влияние препарата на процессы репарации ДНК.
К 100-му дню эксперимента выявленная ранее тенденция сохранилась: группа отрицательного контроля демонстрировала дальнейшее снижение экспрессии, что может быть связано с возрастными изменениями или адаптационными процессами. Наибольший интерес представляют данные группы ТАА+МГ-10, где зафиксированы максимальные значения экспрессии гена Chek1. Хотя различия не достигли статистической значимости (p = 0,129), этот факт может косвенно свидетельствовать о возможном протекторном действии препарата, стимулирующего системы репарации ДНК в условиях хронического токсического воздействия.
На рис. 3 представлены фотографии микропрепаратов почек крыс на 50-й день эксперимента. В контрольной группе (рис. 3, А) структура тканей оставалась без патологических изменений. При введении ТАА (рис. 3, В) архитектоника почек не изменялась.
В группе с введением ТАА и коррекцией адеметионином (рис. 3, С) наблюдались незначительные изменения – скопление лейкоцитов в капиллярах и очаговая инфильтрация стромы, но без дегенеративных процессов. В группе с воздействием ТАА и коррекцией соединением «МГ-10» (рис. 3, D) структура почек соответствовала контрольной группе.
На рис. 4 представлены фотографии микропрепаратов почек крыс в конце периода воздействия. Гистологическое исследование микропрепаратов контрольной группы показало, что ткани сохраняли нормальную морфологическую структуру без признаков патологических изменений (рис. 4, А). Во второй группе крыс, подвергшихся воздействию ТАА, при детальном исследовании канальцев в корковом слое наблюдались признаки обширных патологических изменений: набухание и помутнение цитоплазмы эпителиальных клеток, что сопровождалось затруднением визуализации клеточных границ и очертаний ядер (рис. 4, В). Просветы большинства канальцев были практически неразличимы.
При микроскопии с большим увеличением в цитоплазме клеток были обнаружены многочисленные мелкие белковые включения (зерна) розоватого цвета. При этом структура почечных телец и сосудистых клубочков оставалась неизмененной.
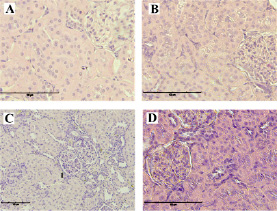
Рис. 3. Микропрепараты почек крыс через 50 дней эксперимента: А – Группа отрицательного контроля. Окраска гематоксилином и эозином, ×400; В – Группа положительного контроля. Окраска гематоксилином и эозином, ×400; C – Третья группа (коррекция адеметионином). Скопление лейкоцитов в корковом слое почек (1). Окраска гематоксилином и эозином, ×200. D – Четвертая группа (коррекция соединением «МГ-10»). Окраска гематоксилином и эозином, ×400
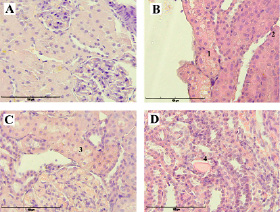
Рис. 4. Микропрепараты почек крыс через 100 дней эксперимента: А – Группа отрицательного контроля. Окраска гематоксилином и эозином, ×400; В – Мелкие зерна красноватого цвета в проксимальных канальцах (1) с набухшей цитоплазмой эпителиальных клеток и суженным просветом канальцев (2) в группе положительного контроля. Окраска гематоксилином и эозином, ×400; C – Цитоплазма эпителия канальцев забита белковыми гранулами (3), в группе, где применялась коррекция адеметионином. Окраска гематоксилином и эозином, ×400; D – Гомогенные отложения розового цвета (4) в эпителии извитых канальцев почки в группе, где применялась коррекция соединением «МГ-10». Окраска гематоксилином и эозином, ×400
У крыс, получавших ТАА на фоне коррекции адеметионином, было выявлено помутнение цитоплазмы в большинстве канальцев, стертость клеточных границ и сужение их просветов (рис. 4, С). При большом увеличении было отмечено, что почечные клубочки не претерпели изменений и имели умеренное кровенаполнение. В цитоплазме клеток наблюдались мелкие зерна красноватого цвета, а в некоторых канальцах сохранялись просветы, хотя местами цитоплазма приобретала «пенистый» вид. Также были зафиксированы единичные участки лейкоцитарной инфильтрации.
В группе крыс, получавших ТАА на фоне коррекции соединением «МГ-10», сосудистые клубочки оставались без видимых изменений. Однако в цитоплазме клеток извитых канальцев обнаруживались мелкие розоватые включения. При большом увеличении в эпителиальных клетках фиксировались эозинофильные белковые зерна. Эпителий извитых канальцев на всех полях зрения был набухшим, просветы канальцев сужены, а клеточные границы слабо различимы. Дополнительно в мозговом слое почек были выявлены единичные гомогенные отложения розового цвета в эпителии извитых канальцев (рис. 4, D).
Проведенные исследования свидетельствуют, что хроническое воздействие ТАА приводит к патологическим изменениям в почках крыс. Полученные результаты согласуются с данными литературы, которые подтверждают, что ТАА является мощным нефротоксином, вызывающим дегенеративные и воспалительные процессы в почках [4, 15].
При гистологической оценке микропрепаратов у всех групп, подвергшихся воздействию ТАА, к концу эксперимента были обнаружены признаки зернистой дистрофии почек, включая набухание цитоплазмы эпителиальных клеток, сужение просвета канальцев и наличие белковых включений. При этом в группе, где применялось соединение «МГ-10», патологические изменения были менее выражены.
Полученные результаты, несмотря на отсутствие статистической значимости, представляют ценность для понимания молекулярных механизмов ответа почечной ткани на токсическое воздействие. Они могут войти в основу для дальнейших исследований в области разработки стратегий фармакологической защиты почек при хронических интоксикациях.
Заключение
Длительное воздействие тиоацетамида в дозе 50 мг/кг массы тела вызывает патологические изменения в почках крыс. Отсутствие значимых различий между группами в уровне экспрессии гена Chek1 не исключает возможных изменений в активности других компонентов системы репарации ДНК. По сравнению с референтным действующим веществом (адеметионином), наиболее эффективным средством медикаментозной коррекции повреждений, индуцированных тиоацетамидом, является комплексное соединение оксиметилурацила с ацетилцистеином.
Библиографическая ссылка
Репина Э.Ф., Каримов Д.Д., Хмель А.О., Рябова Ю.В., Валова Я.В., Ахмадеев А.Р., Хуснутдинова Н.Ю., Каримов Д.О. ВЛИЯНИЕ МЕДИКАМЕНТОЗНОЙ КОРРЕКЦИИ НА ЭКСПРЕССИЮ ГЕНА CHEK1 И ПАТОМОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ В ПОЧКАХ КРЫС ПРИ ДЛИТЕЛЬНОМ ВОЗДЕЙСТВИИ ТИОАЦЕТАМИДА // Научное обозрение. Медицинские науки. 2025. № 2. С. 26-31;URL: https://science-medicine.ru/ru/article/view?id=1438 (дата обращения: 24.12.2025).
DOI: https://doi.org/10.17513/srms.1438
 science-review.ru
science-review.ru