Введение
Тиоацетамид (ТАА) представляет собой сероорганическое соединение, которое не встречается в природе, является искусственно созданным веществом и активно применяется в различных сферах человеческой деятельности. ТАА широко используется в качественном неорганическом анализе в качестве источника сульфид-ионов, что позволяет получать сульфиды металлов при взаимодействии с водными растворами таких катионов металлов, как никель, свинец и ртуть. Его применяют в качестве стабилизатора моторного топлива и ускорителя вулканизации каучука, в кожевенной, текстильной и бумажной промышленности. ТАА ранее также применялся в качестве фунгицида, в настоящее время широко используется в экспериментальной токсикологии как модельное соединение, способное вызывать повреждения печени и других органов [1]. Токсичность ТАА обусловлена его метаболическим превращением в печени с участием цитохрома P450 до высокореактивных метаболитов – тиоацетамид-S-оксида и тиоацетамид-S-диоксида. Эти метаболиты проявляют цитотоксическое действие как за счет ковалентного связывания с макромолекулами, так и посредством индуцированного оксидативного стресса, сопровождающегося генерацией свободных радикалов и истощением антиоксидантных систем защиты. Реактивные метаболиты тиоацетамида оказывают токсическое действие посредством двух основных механизмов: прямого взаимодействия с клеточными макромолекулами (образуя ковалентные аддукты с белками, липидами и нуклеиновыми кислотами) и опосредованного воздействия через индукцию оксидативного стресса. Последний сопровождается массивной генерацией свободных радикалов, истощением антиоксидантных систем [2]. При этом даже однократное воздействие ТАА способно инициировать повреждение печени и нарушение ее детоксикационной функции, что влечет за собой системное распространение токсических соединений, включая аммиак, обладающий нефротоксичностью [3]. Кроме того, кинетика образования и накопления метаболитов ТАА характеризуется насыщаемостью и значительной индивидуальной вариабельностью, что затрудняет прогнозирование степени и направленности органных повреждений [4].
Почки, играя ключевую роль в элиминации метаболитов и поддержании гомеостаза, становятся уязвимыми мишенями при нарушении функции печени и системной оксидативной нагрузке. Острые и хронические поражения почек, развивающиеся на этом фоне, ассоциированы с высоким риском инвалидизации и летального исхода [5, 6]. В настоящем исследовании авторы сосредоточились на оценке потенциальных терапевтических стратегий, направленных на коррекцию почечных нарушений при остром воздействии модельного токсиканта. Одним из перспективных направлений является использование средств с антиоксидантными и мембраностабилизирующими свойствами, способных эффективно вмешиваться в патогенетические механизмы токсического действия на клеточном уровне. В частности, адеметионин (S-аденозилметионин) и комбинация 5-гидрокси-6-метилурацила с ацетилцистеином могут потенциально модулировать экспрессию генов антиоксидантной защиты и снижать выраженность тканевого окислительного стресса.
Цель исследования – оценить влияние адеметионина и комплекса 5-гидрокси-6-метилурацила с ацетилцистеином на экспрессию генов антиоксидантного ответа (Hmox1, Nqo1) в почечной ткани крыс при хроническом воздействии тиоацетамида
Материалы и методы исследования
Исследование было спланировано с учетом международных рекомендаций ARRIVE по гуманному использованию лабораторных животных. Протокол эксперимента утвержден локальным биоэтическим комитетом (решение № 01-02 от 08.02.2024) и полностью соответствовал нормативным требованиям РФ к работе с экспериментальными животными.
56 аутбредных крыс-самцов массой 170–190 г (возраст 12–14 недель) содержались в стандартных условиях вивария. Температурный режим поддерживался на уровне 21–26 °C, животные содержались при 12-часовом световом цикле с автоматическим переключением. Был обеспечен свободный доступ к воде и стандартному корму для лабораторных животных. Перед началом эксперимента животные прошли 5-дневную акклиматизацию.
Животные были рандомизированы на четыре группы (n = 14 для каждой группы). Первая группа являлась положительным контролем и получала раствор тиоацетамида (ТАА) в дозе 50 мг/кг массы тела. Вторая и третья группы получали аналогичное токсическое воздействие на фоне коррекции – адеметионина в виде лекарственного препарата «Самеликс», (ООО Фирма «Фермент», Россия) в разовой дозе 25 мг/кг массы тела за 1 ч до ТАА (ТАА + С); либо экспериментального комплексного соединения 5-гидрокси-6-метилурацила с ацетилцистеином в разовой дозе 500 мг/кг массы тела, разработанного Уфимским институтом химии Российской академии наук [7]. Четвертая группа являлась отрицательным контролем и получала эквивалентный объем физиологического раствора (К). Продолжительность эксперимента составила 100 дней с промежуточным контролем на 50-й день.
По окончании эксперимента животных подвергали эвтаназии путем декапитации. Почечную ткань забирали немедленно после эвтаназии для последующего молекулярно-генетического анализа. РНК выделяли из тканевых образцов органа с использованием набора ExtractRNA («Евроген», Россия) в строгом соответствии с инструкциями производителя. Синтез кДНК осуществляли с применением набора реактивов MMLV RT kit и праймеров олиго(dT)15 («Евроген», Россия). Для исследования транскрипции генов использовали метод полимеразной цепной реакции в режиме реального времени, при котором применяли специфичные олигонуклеотидные праймеры и интеркалирующий краситель SYBR Green. Ген Gapdh служил внутренним контролем. Для оценки относительной экспрессии генов использовался метод, предложенный K.J. Livak и T.D. Schmittgen [8]. Для определения разницы между группами рассчитывался показатель ΔΔCT, который представлял собой разность между средним значением ΔCT группы сравнения и группы контроля. Результирующее значение, полученное посредством экспоненциального преобразования этой разности, интерпретировалось как «fold change» (FC), что позволяло оценить, насколько изменена экспрессия целевого гена в исследуемой группе относительно контроля. Были выбраны ген, кодирующий гем-оксигеназа 1 (Hmox1), который считается одним из наиболее чувствительных и надежных индикаторов клеточного окислительного стресса (идентификатор гена согласно NCBI: 24451) [9]. Изучали уровень экспрессии гена. кодирующего NAD(P)H-хиноноксидоредуктазу 1 (Nqo1) – ключевой фермент детоксикации, играет важную роль в хемопротекции, катализирующий восстановление хинонов и участвующий в антиоксидантной защите посредством генерации восстановленных форм убихинона и витамина Е (идентификатор гена согласно NCBI: 24314) [10].
Статистический анализ проводили с использованием программного обеспечения SPSS Statistics 21.0 (IBM, USA). В качестве критерия нормальности распределения признаков в изучаемых группах использовали критерий Колмогорова – Смирнова. При нормальном распределении данных для оценки значимости различий между группами использовали однофакторный дисперсионный анализ (ANOVA) и апостериорные критерии Тьюки и Тамхейна. Данные представлены как среднее арифметическое и стандартная ошибка. Статистический анализ данных проводился с использованием метода бутстрап (Bootstrap), что обеспечивало надежность и воспроизводимость результатов через многократную генерацию выборок методом Монте-Карло. Различия считали статистически значимыми при р < 0,05.
Результаты исследования и их обсуждение
В отличие от хорошо изученных гепатотоксических эффектов, нефротоксическое действие ТАА остается менее исследованным. При длительном воздействии описаны гломерулярные нарушения, застойные явления, повышение уровней креатинина и мочевины, а также активация провоспалительных и оксидативных путей [11, 12]. Однако молекулярные механизмы этих изменений, особенно в условиях хронической нагрузки, остаются недостаточно ясными, что обусловливает актуальность оценки экспрессии антиоксидантных генов в почечной ткани.
Выбор генов Hmox1 и Nqo1 в качестве маркеров клеточного ответа обусловлен их ключевой ролью в системе антиоксидантной защиты. Hmox1 кодирует гемоксигеназу-1 – чувствительный индикатор оксидативного стресса, Nqo1 – фермент второй фазы детоксикации, участвующий в восстановлении хинонов и защите от реактивных метаболитов [9, 10]. Оба гена используются как универсальные маркеры включения клеточной защиты при воздействии ксенобиотиков.
Полученные в проведенном исследовании результаты демонстрируют ограниченную реактивность антиоксидантных генов в почках на фоне хронического воздействия ТАА. Как видно на рис. 1, на 50-й день воздействия кратность экспрессии гена Nqo1 в ткани почек крыс статистически значимо не отличалась между контрольной группой и группой ТАА (–7,26 ± 0,28 против –7,17 ± 0,09; p = 0,783). Однако при сопоставлении группы ТАА с группой ТАА + Самеликс было зафиксировано достоверное повышение экспрессии Nqo1 (–7,17 ± 0,09 против –6,82 ± 0,09; p = 0,047), что согласуется с известным эффектом адеметионина на метаболизм глутатиона и метилирование промоторов антиоксидантных генов [13, 14]. В группе ТАА +М уровень экспрессии не отличался от контроля и от ТАА (p > 0,05), что может быть связано с реализацией эффекта комплекса 5-гидрокси-6-метилурацила с ацетилцистеином в обход транскрипционной активации Nrf2, за счет прямого донорства SH-групп или непрямого модулирования репаративных путей [15]. На 100-й день воздействия статистически значимых изменений экспрессии Nqo1 ни в одной из групп по сравнению с контролем выявлено не было (p > 0,05).
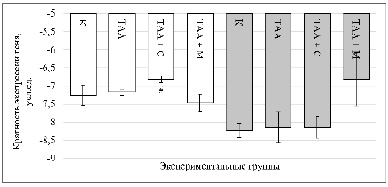
Рис. 1. Изменение кратности экспрессии гена Nqo1 в ткани почек крыс при субхроническом (50 дней) и хроническом (100 дней) воздействии ТАА и на фоне фармакологической коррекции. По оси ординат – относительная кратность экспрессии (нормализована к Gapdh), по оси абсцисс – экспериментальные группы. * – статистически значимые различия (p < 0,05) по сравнению с группой отрицательного контроля (К) соответствующего временного периода; # – статистически значимые различия (p < 0,05) по сравнению с группой ТАА соответствующего временного периода. Белые столбцы – 50 дней воздействия, серые – 100 дней Источник: составлено авторами на основании полученных экспериментальных данных
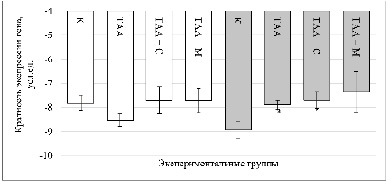
Рис. 2. Изменение кратности экспрессии гена Hmox1 в ткани почек крыс при субхроническом (50 дней) и хроническом (100 дней) воздействии ТАА и на фоне фармакологической коррекции. По оси ординат – относительная кратность экспрессии (нормализована к Gapdh), по оси абсцисс – экспериментальные группы. * – статистически значимые различия (p < 0,05) по сравнению с группой отрицательного контроля (К) соответствующего временного периода; # – статистически значимые различия (p < 0,05) по сравнению с группой ТАА соответствующего временного периода. Белые столбцы – 50 дней воздействия, серые – 100 дней Источник: составлено авторами на основании полученных экспериментальных данных
Как видно на рис. 2, экспрессия гена Hmox1 на 50-й день достоверно не отличалась между всеми исследуемыми группами, что указывает на отсутствие выраженной активации антиоксидантного ответа в изученные сроки воздействия. К 100-му дню воздействия наблюдалось статистически значимое снижение экспрессии Hmox1 в группе ТАА по сравнению с контролем (–8,93 ± 0,32 против –7,89 ± 0,20; p = 0,036), что может отражать истощение компенсаторного ответа на фоне хронической нагрузки. При этом в группе ТАА + Самеликс также было зафиксировано достоверное различие по сравнению с контролем (–8,93 ± 0,32 против –7,69 ± 0,34; p = 0,042), тогда как в группе ТАА + МГ-10 изменения не достигали статистической значимости (p > 0,05).
Суммарно данные указывают на то, что молекулярный отклик почек при хроническом воздействии ТАА развивается медленно, с ограниченной включенностью транскрипционных антиоксидантных механизмов. Согласно результатам проведенного исследования, адеметионин оказывал более выраженное действие на экспрессию Nqo1 на раннем этапе, но не предотвращал снижение Hmox1 в поздний срок, тогда как комплекс 5-гидрокси-6-метилурацила с ацетилцистеином не модулировал Nqo1, но демонстрировал тенденцию к сохранению кратности экспрессии на уровне отрицательного контроля гена Hmox1 к 100-му дню. Это может свидетельствовать о различиях в точках приложения действия препаратов: адеметионин преимущественно активирует эпигенетические и метаболические пути антиоксидантного ответа, а комплекс 5-гидрокси-6-метилурацила с ацетилцистеином действует скорее через стабилизацию митохондрий и подавление вторичного воспалительного каскада, не вовлекая напрямую путь Nrf2.
Полученные данные важны для развития направлений, связанных с фармакологической коррекцией нефротоксических эффектов, возникающих при хроническом токсическом воздействии. Показанная ограниченность включения антиоксидантного ответа в ткани почек при экспозиции тиоацетамидом может указывать на латентное течение патологического процесса. Перспективным направлением также является расширение панели молекулярных маркеров с включением генов воспалительного ответа, апоптоза и митохондриального гомеостаза, а также комплексное сопоставление молекулярных данных с биохимическими и морфологическими характеристиками. Это позволит сформировать более полное представление о патогенезе ТАА-индуцированной нефротоксичности и создать обоснованную платформу для оценки эффективности коррекционных воздействий.
Заключение
В условиях хронического воздействия тиоацетамида в почечной ткани крыс не зафиксировано выраженной активации генов антиоксидантного ответа. Установлено, что адеметионин способен усиливать экспрессию Nqo1 на ранних сроках воздействия, тогда как 5-гидрокси-6-метилурацил с ацетилцистеином статистически значимых изменений не показал, что свидетельствует о различии в механизмах их действия.
Конфликт интересов
Финансирование
Библиографическая ссылка
Рябова Ю.В., Смолянкин Д.А., Каримов Д.Д., Кудояров Э.Р., Якупова Т.Г., Репина Э.Ф., Каримов Д.О. ЭФФЕКТИВНОСТЬ АДЕМЕТИОНИНА И ПРОИЗВОДНОГО УРАЦИЛА В КОРРЕКЦИИ ИЗМЕНЕНИЙ КРАТНОСТИ ЭКСПРЕССИИ ГЕНОВ АНТИОКСИДАНТНОЙ ЗАЩИТЫ В ПОЧКАХ КРЫС ПРИ ДЛИТЕЛЬНОМ ВОЗДЕЙСТВИИ ТИОАЦЕТАМИДА // Научное обозрение. Медицинские науки. 2025. № 4. С. 12-16;URL: https://science-medicine.ru/ru/article/view?id=1449 (дата обращения: 24.12.2025).
DOI: https://doi.org/10.17513/srms.1449
 science-review.ru
science-review.ru