Изучение последствий воздействия на организм стресса приобретает особое значение, так как он инициирует комплекс разнообразных реакций. При чрезмерном или длительном воздействии стресса или неполноценности какого-либо звена системы адаптации нарушения могут быть обнаружены на уровне соматических функций [7, 11]. Последствия стресса могут трансформироваться в ведущий фактор патогенеза ряда болезней, в том числе, связанных с нарушением иммунной системы.
Цель работы – исследовать возможности вилона воздействовать на морфологию селезенки в условиях экспериментальной патологии, вызванной гиподинамическим стрессом.
Материалы и методы исследования
Наши исследования проведены на 58 беспородных белых крысах-самцах (возраст 3-5 мес.) весом 160 – 200 гр. Использовали острый иммобилизационный стресс (ОИС). За основу взят метод О.Н. Забродина (1982), модифицированный соответственно нашим условиям [82]. За сутки до эксперимента крысы лишались пищи при свободном доступе к воде. Затем животных фиксировали на деревянных станках в положении на спине, привязывая конечности. Для профилактики некрозов через каждые 2 часа конечность (последовательно по одной) освобождалась от лигатур на 5 минут. Фиксация продолжалась 24 часа. В течение этого времени наблюдалось двигательное беспокойство животных, попытки освободиться.
Для гистологического исследования материал фиксировали при + 4 °С в жидкости Карнуа, 10 % нейтральном формалине, заливали в парафин и целлоидин. Срезы парафиновых и целлоидиновых блоков толщиной 5 и 10 мкм соответственно окрашивали общеморфологическими методиками: гематоксилин-эозином, азур II-эозином, по ван Гизону. Углеводный компонент окрашивали ШИК-реакцией по Мак-Манусу в прописи Лилли, ДНК – по методу Фельгена. Для элективного выявления лаброцитов использована окраска бисмарк-брауном по Шубичу, а для определения плазматических клеток в стенке желудка – пиронином-метиленовым зеленым по Браше. Аргирофильные ретикулиновые волокна выявляли импрегнацией серебром по Футу.
Микроморфометрию проводили под микроскопом МБР-1 методом точечного счета с помощью окулярной стереометрической сетки Г.Г. Автандилова и окуляр-микрометра МОВ-15. Число лаброцитов подсчитывали при увеличении микроскопа х600 на 1 мм2 слизистой оболочки в 10 полях зрения. Масса органов всех животных определялась с точностью до 1 мг.
После создания острого иммобилизационного стресса (ОИС) животные были разделены на 2 группы: 1- получала физраствор (1,0 мл) , 2 – вилон в дозе 10 мкг. Пептидный тимомиметик вилон (Lys-Glu) получен путем направленного химического синтеза на основании аминокислотного анализа комплексного препарата тимуса – тималина [1, 5]. Вилон или физраствор вводили внутримышечно 1 раз в сутки на протяжении 10 дней подряд. Забор материала проводили на вторые, девятые и двадцать первые сутки эксперимента. Сравнение проводили с интактными крысами. Для изучения протекторного действия вилон вводили 1 раз в сутки в течение 3 дней, предшествующих эксперименту, и во время стресса каждые 6 часов по 10 мкг внутримышечно. Значимость различий оценивали по t-критерию Стьюдента и χ2 Пирсона.
Результаты исследования и их обсуждение
В первые сутки после ОИС у крыс наблюдалась общая реакция в виде заторможенности, снижения аппетита, жажды, у некоторых животных отмечалось затруднение движений вследствие синюшности и отека дистальных отделов конечностей. Селезенка интактных животных имела массу 1079,7 ± 11,6 мг и с поверхности была покрыта фиброзной капсулой. От капсулы внутрь органа отходили трабекулы, между которыми залегала белая и красная пульпа (рис. 1).
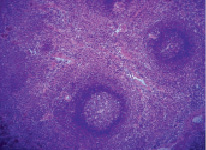
Рис. 1. Селезенка интактных животных. Окраска гематоксилин-эозин. Увеличение 120
Белая пульпа была представлена лимфоидными узелками и периартериальными лимфоидными влагалищами (ПАЛВ). Лимфоидный узелок состоял из плотно расположенных мелких лимфоцитов, имел округлую или овальную форму. Его площадь у интактных животных равнялась 585,2 ± 9,4 мкм2.
В зависимости от функционального состояния фолликул мог содержать герминативный центр или не иметь его, так как образование герминативного центра происходит только при антигенной стимуляции. Центр размножения повторял форму лимфоидного узелка, имел светлую окраску и был образован крупными клетками со светлыми ядрами и базофильной цитоплазмой. Его площадь составляла 234,7 ± 2,5 мкм2.
С поверхности герминативный центр был окружен более темноокрашенной мантийной зоной, образованной 2-4 слоями компактно расположенных мелких и средних лимфоцитов, формирующих корону узелка. Периартериальные лимфоидные влагалища располагались вокруг центральной артерии и были построены достаточно однородно. Они были образованы 2-4 рядами мелких и средних лимфоцитов, разделенных концентрическими слоями ретикулярных волокон. Большинство лимфоцитов имели фенотип Т-хелперов.
Маргинальная (пограничная) зона лежала на границе с красной пульпой и являлась общей для лимфатического узелка и ПАЛВ. Она была образована рыхло расположенными клетками и многочисленными капиллярами. Ее площадь составляла 46,83 ± 1,68 мкм2. Маргинальная зона всегда является местом формирования иммунного ответа независимо от вида антигена и способа его внедрения. Кроме того, маргинальная зона служит местом поступления из центральных органов кроветворения предшественников Т- и В-лимфоцитов, расселяющихся в соответствующие зоны.
Красная пульпа была образована ретикулярными клетками, ретикулиновыми волокнами и венозными синусами. Из клеточных элементов в ней находились эритроциты и небольшое количество равномерно расположенных мононуклеарных лейкоцитов. Процентное соотношение белой и красной пульпы составляло 14,6 % и 81,3 % соответственно.
На вторые сутки после стресса аргирофильные волокна капсулы были неравномерно импрегнированы серебром, по ходу волокон наблюдались утолщения, чередующиеся с истонченными участками. Масса органа снижалась до 930,8 ± 13,9 мг в первой и 978,5 ± 12,3 мг во второй группах соответственно.
Четко выявлялась неравномерная плотность в расположении клеточных элементов красной пульпы. Сразу под капсулой формировалась светлоокрашенная зона, бедная лимфоцитами (рис. 2). Ширина её в разных отделах колебалась от 50 до 75 мкм, а в области ворот зона, практически лишенная лимфоцитов, достигала 300 мкм. Вместо диффузного расположения клеток, характерного для контрольных животных, лимфоциты формировали многочисленные скопления различной величины и формы. В отдельных участках красной пульпы наблюдались мелкоочаговые кровоизлияния. Венозные синусы расширены и полнокровны.
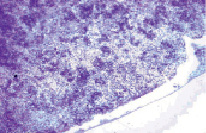
Рис. 2. Группы лимфоцитов в красной пульпе селезенки. Крысы, получавшие физиологический раствор. Вторые сутки после острого иммобилизационного стресса. Окраска гематоксилин-эозин. Увеличение 120
Значительные изменения претерпевала белая пульпа. Площадь лимфоидных фолликулов и плотность расположения в них лимфоцитов уменьшалась в 2,1 раза, что наряду с локальным расширением межклеточных щелей свидетельствовало о нарастающей делимфатизации. Это приводило к появлению бледноокрашенных телец-теней (рис. 3).
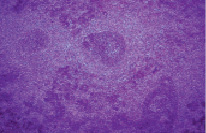
Рис. 3. Делимфатизация белой пульпы и формирование телец-«теней» (стрелка). Крысы, получавшие физиологический раствор. Вторые сутки после острого иммобилизационного стресса. Окраска гематоксилин-эозин. Увеличение 120
В 3,25-3,5 раза снижалась площадь герминативных центров, вплоть до полного исчезновения некоторых из них (таблица). Поэтому количество лимфатических узелков, имеющих герминативные центры, была в 1,3 раза меньше, чем у контрольных животных. В тоже время площадь, занимаемая маргинальной зоной, возрастала достигая 67,1 ± 3,64 мкм2 и 69,4 ± 2,21 мкм2 у крыс 1 и 2 групп соответственно.
Площадь некоторых структур белой пульпы селезенки (мкм2)
|
Лимфоидный узелок |
Герминативный центр |
Маргинальная зона |
|
|
Интактные животные |
585,24 ± 3,62 |
234,75 ± 2,51 |
46,8 ± 2,68 |
|
Вторые сутки |
|||
|
1 группа |
288,87 ± 9,05 р1 < 0,05 |
66,24 ± 3,18 р1 < 0,05 |
67,17 ± 3,64 р1 < 0,05 |
|
2 группа |
281,98 ± 7,12 p1 < 0,05; p2 < 0,01 |
72,83 ± 3,49 p1 < 0,05; p2 < 0,01 |
69,41 ± 2,21 p1 < 0,05; p2 < 0,01 |
|
Девятые сутки |
|||
|
1 группа |
402,71 ± 4,28 р1 < 0,05 |
102,51 ± 2,75 р1 < 0,05 |
58,17 ± 1,93 р1 < 0,05 |
|
2 группа |
456,65 ± 5,32 p1 < 0,05; p2 < 0,01 |
139,68 ± 4,92 p1 < 0,05; p2 < 0,01 |
48,36 ± 2,16 p1 < 0,05; p2 < 0,01 |
|
Двадцать первые сутки |
|||
|
1 группа |
509,76 ± 3,14 р1 < 0,05 |
184,45 ± 2,92 р1 < 0,05 |
51,62 ± 2,46 р1 < 0,05 |
|
2 группа |
594,14 ± 9,15 p1 < 0,05; p2 < 0,01 |
240,45 ± 3,18 p1 < 0,05; p2 < 0,01 |
45,43 ± 2,21 p1 < 0,05; p2 < 0,01 |
|
Протекторное действие |
|||
|
1 группа |
296,90 ± 9,05 р1 < 0,05 |
92,14 ± 6,22 р1 < 0,05 |
71,56 ± 4,95 р1 < 0,05 |
|
2 группа |
562,24 ± 8,69 p1 > 0,05; p2 < 0,01 |
224,52 ± 7,53 p1 > 0,05; p2 < 0,01 |
44,7 ± 3,69 p1 > 0,05; p2 < 0,01 |
Примечания: p1 – значимость различий по сравнению с интактными крысами; p2 – значимость различий между группами животных, получавших вилон и физраствор.
Увеличение ширины маргинальной зоны по сравнению с контролем могло свидетельствовать о том, что, несмотря на существенно больший приток лимфоцитов и макрофагов к белой пульпе не все поступившие лимфоциты проходят стадию пролиферации и дифференцировки вплоть до образования плазмоцитов, продуцирующих иммуноглобулины.
У стрессированных крыс увеличивалась ширина ПАЛВ и плотность расположения в ней лимфоцитов в 1,2 раза у крыс 1 группы и в 1,6 раза у крыс 2 группы. На поперечных и продольных срезах селезенки лимфоидные муфты имели интенсивную окраску и были образованы малыми и средними лимфоцитами, формирующими 6-9 рядов радиально расположенных цепочек (рис. 4).
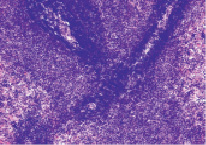
Рис. 4. Периартериальное лимфоидное влагалище (стрелка). Крысы, получавшие вилон. Вторые сутки после острого иммобилизационного стресса. Окраска гематоксилин-эозин. Увеличение 200
В ответ на стресс-реакцию изменялись кровеносные сосуды. Ядра эндотелиальных клеток часто деформированы, располагались на вершинах складок. Внутренняя эластическая мембрана утолщена, растянута. Эластические волокна средней оболочки извиты и фрагментированы. Гладкомышечные клетки уплощены, их ядра спиралевидно скручены.
При гистохимическом исследовании найдено усиленное периваскулярное накопление ШИК-позитивных веществ вокруг сосудов микроциркуляторного русла и очаговая метахромазия, что свидетельствовало об увеличении проницаемости сосудистой стенки и развитии отека. В просвете сосудов формировались агрегаты форменных элементов крови и пристеночные тромбы.
Морфометрические параметры, полученные на 9 сутки после острого иммобилизационного стресса, свидетельствовали о повышении функциональной активности органа. У крыс обеих экспериментальных групп увеличивалась масса селезенки, снижалась толщина капсулы, хотя в ней сохранялось некоторое количество деформированных аргирофильных волокон. В красной пульпе мононуклеарные элементы были распределены преимущественно равномерно, поэтому сохранялись лишь единичные очаговые клеточные скопления.
Иммунный аппарат белой пульпы восстанавливался, но динамика его активизации была неодинакова у крыс разных экспериментальных групп. Более выраженная лимфатизация происходила у крыс, получавших вилон, о чем свидетельствовало увеличение размеров лимфоидных фолликулов на 61,9 % (р < 0,001) и практически вдвое на 91,8 % площади герминативного центра с одновременным ростом числа фолликулов, имеющих эту структуру. Дополнительным признаком стабилизации органа являлось сокращение площади маргинальной зоны, которая у крыс 1 и 2 групп уменьшалась на 15,4 % и 43,5 % соответственно.
ПАЛВ были четко выражены, образованы радиальными цепочками лимфоцитов. Согласно данным литературы образование «цепочек», состоящих из различных типов Т-лимфоцитов, свидетельствует о кооперации клеток, участвующих в иммунном ответе [428, 608]. Просветы сосудов у крыс 1 группы были умеренно спавшиеся, в части из них обнаруживались сладжи эритроцитов. Аргирофильные волокна имели вид нежной сеточки, контурирующей трабекулярные и пульпарные артерии и вены.
Динамика морфологических изменений белой пульпы на 21 день свидетельствовала об увеличение объема лимфоидной ткани в органе, поэтому масса селезенки практически достигала контрольных цифр, особенно у крыс 2 группы. Это подтверждалось тем, что к 21 дню размеры лимфатических узелков на фоне введения вилона возросли в 2,1 раза, что на 51,3 % больше, чем у крыс 1 группы. Важным моментом в ответ на введение вилона явилось увеличение в 1,5 раза числа фолликулов с герминативным центром, что на морфологическом уровне свидетельствует об активации иммунной реакции селезенки. Восстановление структурной организации и цитоархитектоники органа, начинающееся с 9 суток, на фоне введения вилона достигало контрольных цифр к 21 дню. У нелеченых крыс к этому сроку полностью восстановились не все морфологические показатели.
Полученные данные свидетельствуют о том, что ОИС вызывал значительные изменения морфофункционального состояния селезенки, а их восстановление происходило неодинаково у крыс разных экспериментальных групп. Введение терапевтических доз вилона усиливало функциональную активность лимфоидной ткани и уровень лимфопоэза в ней, что является морфологическим отражением усиления функции гуморального звена иммунитета. Вилон ликвидирует нарушения иммунитета при различных патологических состояниях [6, 8, 9, 12, 13]. Показано положительное действие других синтетических пептидов в эксперименте [2, 3, 4].
Таким образом, вилон оказывают нормализующее влияние на структуру селезенки и, в конечном итоге, на иммунный ответ, усиливая его в случае подавления действием чрезмерных повреждающих факторов. Тимомиметик вилон ликвидирует иммунные нарушения, вызванные стрессом, и оказывает протекторное действие при введении его до стресса.
Библиографическая ссылка
Щербак В.А. ВЛИЯНИЕ ВИЛОНА НА МОРФОМЕТРИЧЕСКИЕ ПОКАЗАТЕЛИ СЕЛЕЗЕНКИ В ЭКСПЕРИМЕНТЕ // Научное обозрение. Медицинские науки. 2016. № 5. С. 123-127;URL: https://science-medicine.ru/ru/article/view?id=937 (дата обращения: 08.03.2026).
 science-review.ru
science-review.ru