Уход за пациенткой с раком молочной железы (РМЖ) до/после лечения и во время реабилитации зависит от индивидуальных клинических особенностей, включая стадию проявления и разновидность РМЖ, генетические факторы предрасположенности, степень ответа пациентов на неоадъювантную терапию до операции и их предпочтения. Необходима интеграция клинической помощи между пациентами и специалистами, требуется также динамическое реагирование со стороны врачей, поскольку они сталкиваются с накоплением клинической информации во время постановки диагноза, а затем последовательно на каждом этапе плана лечения и последующего наблюдения с учетом реакции на лечение пациента [1]. Инвалидизация больных РМЖ остается крайне важным вопросом в связи с частым применением калечащей мастэктомии. Возникает утрата органа и психологические последствия в связи с потерей женственности, сексуальности, привлекательности [2, 3].
Описание способов лечения РМЖ в зависимости от стадии
|
Стадия РМЖ |
Описание |
Лечение |
|
Стадия 0. Протоковая карцинома in situ |
1. Неинвазивна, прогрессирует до рака у 40 %. 2. Если является положительной к рецептору эстрогена |
1. Лампэктомия/облучение или мастэктомия. 2. Эндокринная терапия |
|
Ранние инвазивные стадии (I, IIa, IIb) и местнораспространенные стадии (IIIa, IIIb, IIIc) |
Неметастатические, 3 этапа лечения: (1) предоперационный, (2) хирургический, (3) послеоперационный |
(1) Системная эндокринная или иммунотерапия, может быть химиотерапия; (2) лампэктомия с облучением, или мастэктомия; (3) лучевая, эндокринная терапия, иммунотерапия, химиотерапия |
|
Рак молочной железы IV стадии (метастатический) |
Поддается лечению, но неизлечим, лечение направлено на увеличение продолжительности и качества жизни |
Системная терапия (гормональная, таргетная, химиотерапия) и хирургическое удаление первичной опухоли, но достаточной ожидаемой продолжительности жизни. Альтернативный вариант: лучевая терапия |
Примечание. Составлено по данным [5, 6].
Реконструкция молочной железы – единственный способ восстановления нормального внешнего вида женщины после хирургического лечения РМЖ [4]. В целом лечение РМЖ зависит от стадии (таблица).
Цель исследования – анализ возможностей реконструктивно-восстановительного лечения пациентов с раком молочной железы.
Материалы и методы исследования
Проведен анализ 20 русско- и англоязычных литературных источников. В качестве поисковых баз использованы Cyberleninka, Elibrary, PubMed, SpringerLink.
Результаты исследования и их обсуждение
В 1990-х гг. «золотым стандартом» реконструкции молочных желез (МЖ) являлся TRAM-лоскут, который считался специалистами важнейшим открытием с внедрением трех основных способов TRAM-реконструкции: свободной пересадки и перемещения на мышечной ножке или двух, а также модификации последнего способа посредством наложения дополнительных анастомозов (supercharged TRAM-flap, или TRAM-лоскут с «подкачкой»). Более продвинутыми вариантами являются DIEP- и SIEA-лоскут, получаемые на основе перфорантных глубоких и поверхностных нижних эпигастральных сосудов соответственно [7]. Независимо от выбора технологии реконструкции выделяют срочный и отсроченный способ вмешательства. Первый немедленно начинается во время той же операции, что и мастэктомия или лампэктомия. Критерии выбора срочной реконструкции включают: в целом здорового пациента; рак низкой степени злокачественности; маловероятность необходимости послеоперационной лучевой терапии. На более поздних и неизвестных стадиях РМЖ часть реконструкции можно начать немедленно. Преимущества применения срочной реконструкции включают: сохранение родной кожи и, возможно, соска; меньше процедур; значительный психологический эффект; минимальность риска деформации груди. К недостаткам относят более длительную операцию/восстановление; неизвестную биологию опухоли с вариабельностью потребности в послеоперационной адъювантной терапии. Отложенная реконструкция проводится через месяцы/годы после мастэктомии/лампэктомии и применяется в случае, если: пациент не может переносить более длительную процедуру и восстановление; требуется лучевая терапия после операции; присутствует несколько важных факторов риска (курение, диабет, сосудистые заболевания и т.д.). Достигается основательность принятия восстановительных решений с учетом окончательной патологии опухоли и больше времени на подготовку к восстановлению. Возникает необходимость в нескольких и более сложных операциях из-за отсутствия кожной оболочки и, возможно, соска; психологические последствия деформации груди до выполнения реконструкции [8].
Рассмотренный выше аутологичный (на тканевой основе) вариант реконструкции МЖ приводит к ряду осложнений, частота которых варьирует в зависимости от типа лоскута и особенностей его получения/переноса с передней брюшной стенки: частичную или полную потерю лоскута (для TRAM, DIEP/SIEA: очень редко, ≥ 0,8 %), грыжи и деформации передней брюшной стенки (для TRAM и DIEP/SIEA: 15 и < 5 %), некроз жировой ткани (для TRAM 50 %, для свободных лоскутов 17 %) [7, 9]. В целом данные операции травматичны и технически сложны [7]. Кроме того, требуется достаточный избыток мягких тканей на донорском участке, у пациента должны быть минимальные основные сопутствующие заболевания, отсутствие ожирения. В качестве преимуществ выделяют использование собственной ткани, естественный внешний вид и ощущения, упрощение симметрии в односторонних случаях. Для выполнения данной реконструкции требуется большой донорский сайт и более длительное восстановление, а также больше краткосрочных осложнений, а именно заболеваемость на донорском участке, включая расхождение раны [8]. Выявлено, что лоскут SIEA имеет меньшую частоту грыжи/выпячивания и более высокий уровень тромботических осложнений по сравнению с мышечно-щадящим свободным TRAM-лоскутом (fTRAM), а также по сравнению с DIEP и лоскутом с ножкой (pTRAM) [10, 11]. По сравнению с DIEP у лоскутов fTRAM обнаружено снижение частоты некроза жировой ткани лоскута, гематом и общих тромботических осложнений, но более высокий риск грыжи/выпячивания донорского участка. pTRAM также были связаны с повышенным риском грыжи/выпячивания в донорском участке и раневой инфекции, однако гематома лоскута встречалась реже. При использовании SIEA отмечен высокий риск раневой инфекции. Отмечено, что процедуры fTRAM имели сравнительно меньшее количество осложнений [11].
В области реконструкции МЖ на основе имплантатов были достигнуты многочисленные успехи. Многие из них привели к улучшению результатов лечения и ухода за пациентами. Понимание новых методов и технологий обеспечивает компетентность в оказании помощи пациентке с аллопластической реконструкцией МЖ [12]. Метод аллопластики необходим, когда габитус тела колеблется от среднего до худого (без избытка ткани для аутологичного способа). При аллопластике сроки операции короче, меньше краткосрочных осложнений/шрамов, более быстрое восстановление. Недостатки аллопластики включают многоступенчатость усилий, длительный срок до завершения, трудно достичь симметрии в односторонних случаях, требуется обслуживание/замена имплантата. Среди осложнений выделяют капсулярную контрактуру, неправильное положение, разрыв, пульсацию или видимость имплантата, менее естественный внешний вид и ощущения [8].
Среди методов реконструкции МЖ на момент текущего развития медицинских технологий выделяют оптимальные после частичного или полного удаления МЖ. Так, кожесохраняющая мастэктомия (КСМ) с одномоментной реконструкцией силиконовым эндопротезом относится к одному из лидирующих методов (рисунок) по причинам непродолжительности операции и анестезии (1,5–2 ч) и периода восстановления, а также отсутствия дополнительных рубцов, сохранения естественности кожного чехла и собственной сосково-ареолярной области. Метод основан на использовании силиконовых имплантов последнего поколения, формировании отсутствия физико-психологического дискомфорта и существенной доли применения собственных тканей. Ограничения применения КСМ заключаются в необходимости применения небольших хирургических доступов с удалением препарата единым блоком, что не всегда возможно при лечении РМЖ [13].
Применение КСМ не лишено осложнений, но они находятся в пределах границ общеизвестных рисков/последствий. В основном осложнения удается устранить консервативным/хирургическим путем. Операция отличается высокими эстетико-функциональными показателями, однако существует некоторый процент эстетически неудовлетворенных пациенток, которым необходима симметризирующая коррекция: мастопексия контрлатеральной МЖ, липофиллинг восстановленной/здоровой МЖ, формирование соска, татуаж ареолы [7]. По данным American Society of Plastic Surgeons 80 % реконструкций МЖ в результате онкологических диагнозов проводится с помощью силиконовых эндопротезов. Появилась тенденция к возвращению роста использования препекторального пространства в связи с усовершенствованием методик мастэктомии, состава имплантатов (покрытия/гелевого наполнения) [14]. Применение силиконовых имплантатов МЖ не обеспечило решение ряда проблем [15]: инфекционных осложнений (4–24 %), капсулярной контрактуры (4–74 %), зачастую после лучевой терапии (ЛТ) [16].
В исследовании результатов препекторальной имплантации одновременно с реконструкцией МЖ показана эффективность применения текстурированных (преимущественно у пациенток с начальными с 0–IIa стадиями РМЖ) и полиуретановых (при более тяжелых стадиях рака) имплантатов в 31 и 69 % случаев соответственно. Естественно, химиотерапевтическое лечение выполнялась чаще (в 60 % случаев) после установки последнего, чем после применения текстурированного варианта (в 40 %). Осложнения в основном отмечались после проведения химиотерапии и ЛТ [15].
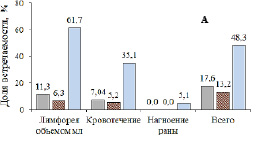
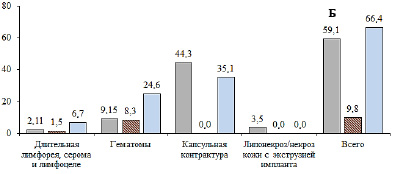
Частота развития ранних (А) и поздних (Б) послеоперационных осложнений. Кожесохраняющая мастэктомия с одномоментной реконструкцией эндопротезом (■), радикальная резекция по данным разных авторов: минимум ( ) и максимум (■). Составлено по данным [7]
Препекторальная (подкожная) реконструкция полиуретановых имплантатов по данным мировых исследований обеспечивает снижение вероятности развития капсулярной контрактуры, фиксационную надежность, отсутствие необходимости укрытия эндопротеза дополнительно. Сейчас преимущества (простота операции, сохранение грудной мышцы, минимальность болевого синдрома, краткосрочность стационарных койко-дней и периода реабилитации) препекторальной установки по сравнению с суб- и ретромускулярными зонами очевидны, единственное ограничение заключается в необходимости достаточной толщины покровных тканей, отсутствии их повреждения, минимизации болевого синдрома [14].
В целом не выявлено разницы в частоте осложнений при выполнении имплантации до ЛТ или после нее. Критериями успешности двухэтапной реконструкции с последующей ЛТ являются индекс массы тела и возраст < 30 и < 50 лет соответственно. Установлено, что оптимально до ЛТ установка временного эндопротеза (тканевого экспандера) на первом этапе с его заменой на постоянный имплантат после ЛТ. В результате достигается минимизация риска осложнений, оптимальный уровень эстетических исходов, в связи с отсутствием облучения собственно тканей пациентки или постоянного имплантата. На заключительной стадии реконструкции можно скорректировать конечный эстетический итог [17]. Известно, что проведение адъювантной ЛТ приводит к липо- и дермонекрозу с последующей экструзией конечного имплантата. Современная аллопластика позволяет выполнять одно- (установка текстурированного/полиуретанового импланта при выполнении мастэктомии) и двухэтапные реконструкции. Известно, что субмускулярная установка тканевого эспандера, заполненного затем физиологическим раствором, позволяет сформировать пространство для дальнейшей имплантации под большой грудной мышцей в нижних и латеральных отделах. После трех недель с момента проведения хирургического вмешательства выполняется замена эспандера на постоянный эндопротез (второй этап реконструкции). Далее через 6 мес. выполняется замена/формирование анатомических структур молочной железы (субмаммарная складка, пятно молочной железы, сосково-ареолярный комплекс). Выявлена высокая эффективность препекторального расположения импланта, однако в зависимости от конституциональных особенностей и необходимости последующего химиолучевого лечения допускается субмускулярная установка. В результате двухэтапной реконструкции достигается постепенность растяжения покровов (формирование кармана большего объема), возможность изменения объема посредством регуляции объема наполнения физиологического раствора. Корригирующая операция на контралатеральной МЖ с целью достижения симметрии необходима в большинстве случаев. Пока применение алломатериалов не обеспечило преодоление таких осложнений, как капсулярная контрактура, серомы, инфекции (до 20, 15 и 5 %). На современном этапе первое место по распространенности занимает двухэтапный метод реконструктивно-пластических операций (79–54 %) по сравнению с одноэтапным подходом, а также комбинированным и аутологичным методами [18].
Таким образом, после экстирпации МЖ имплантация может проводиться с использованием собственных тканей, искусственных имплантатов, комбинационных вариантов (аутологичный, аллопластический и комплексный подходы). Эстетический результат достигается только по достижению симметричного расположения/формы с контралатеральной стороной. Среди аутологичных методов на современном этапе развития медицины выделяют перемещение торако-дорсального лоскута (широчайшей мышцы спины и сосудов), т.е. замена лоскута происходит не с брюшной стенки, а забор необходимого материала выполняется с зоны спины. Метод малотравматичен, надежен, однако только в сочетании с искусственными (силиконовыми, в частности) имплантатами достигается восполнение полного объема МЖ. Недостатки технологии включают: поверхностные рубцы большой площади, деформированное состояние спинного контура при заборе большого объема мышцы, контрастирование кожного тона кожи спины и грудной стенки. Забор TRAM-лоскутов существенно сложнее, а реконструкция посредством искусственных протезов проще и менее травматична, поэтому чаще применяется в маммологической онкологии [4]. Существуют противопоказания к применению торако-дорсального лоскута в реконструкции МЖ. К ним относятся не только тяжесть сопутствующих патологий (ожирение, сахарный диабет), психические заболевания, наличие опухолевых клеток в резекционной зоне и мутированного гена BRCA1-2, стадия рака T4N0-3M0-1, курение и предпереднелатеральная торакотомия в анамнезе, но и непосредственные предпочтения пациентки с учетом ее нежелания наличия рубца на спине [14]. Доказано также, что установка тканевого экспандера до ЛТ с последующей заменой его на постоянныq эндопротез более безопасна и эффективна. Предприняты попытки формирования комбинированного экспандера и эндопротеза (Беккера), установка которых позволяет выполнить эндопротезирование за один этап. Новейшие технологии позволили разработать современные многослойные протезы и гель, обладающий высокой степенью связанности, а также текстурированную поверхность [4]. Оценка влияния ЛТ на местные осложнения у пациенток после лечения РМЖ и аллопластической реконструкции МЖ показала более высокий, но не статистически значимый риск (по сравнению с необлученными пациентами) осложнений, в основном связанных с хирургическим вмешательством (серомы, инфекции, экструзии имплантата, капсулярная контрактура) [19]. Отдельно с небольшим количеством исследований рассматривается роль в реконструкции МЖ аллогенных и ксеногенных бесклеточных дермальных матриц (БДМ), а также синтетических сеток. Выявлено, что двухэтапная реконструкция МЖ с помощью БДМ связана с худшими результатами по сравнению с реконструкцией без БДМ. Тем не менее, роль аллопластических адъюнктов нуждается в дальнейшем исследовании [20].
Реконструкцию сосково-ареолярного комплекса и корригирующие операции на контралатеральной стороне относятся к отсроченным, спустя 6 мес. после первого операционного вмешательства посредством воссоздания соска, кожных лоскутов из паховой складки для восстановления ареола или внутрикожной татуировки. Раннее начало реабилитации позволяет у пациенток, особенно молодого возраста, совпадает с моментом постановки диагноза РМЖ. Данная тенденция позволяет минимизировать нарушения психологического состояния пациентки, на которое впоследствии влияют ранние/поздние послеоперационные осложнения [4].
Заключение
Таким образом, осложнения, характерные для реконструкции молочной железы, зависят от выбранного варианта реконструкции. При проведении аллопластических реконструктивных вмешательств в качестве осложнений выявляют капсульную контрактуру (затвердение внутренней капсулы молочной железы), неправильное положение/измененное расположение имплантата, его визуальную видимость, неестественность внешнего вида/ощущения. Осложнения, более характерные для аутологичной реконструкции, включают осложнения на донорском участке, такие как задержка заживления ран, выпячивание живота или грыжа, а иногда и слабость донорского участка. Трудности в получении хорошей формы, подходящего размера и хорошей симметрии являются проблемами как при реконструкции на основе имплантатов, так и на основе тканей. Аллопластическая реконструкция молочных желез более популярна в связи с большей простотой вмешательства, при этом наиболее эффективным на данный момент является способ двухэтапной реконструкции, особенно при необходимости проведения лучевой терапии.
Библиографическая ссылка
Ноговицина Е.М. РЕКОНСТРУКТИВНО-ВОССТАНОВИТЕЛЬНОЕ ЛЕЧЕНИЕ ПАЦИЕНТОВ С РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ // Научное обозрение. Медицинские науки. 2022. № 5. С. 21-26;URL: https://science-medicine.ru/ru/article/view?id=1285 (дата обращения: 15.12.2025).
DOI: https://doi.org/10.17513/srms.1285
 science-review.ru
science-review.ru